所有手术患者均实现R0切除!基因检测+新辅助治疗能否改写局晚甲状腺癌 “手术难” 命运?
2025-02-08 苏州绘真医学 苏州绘真医学 发表于陕西省
在本研究中,研究者报告了使用新辅助TKI治疗局部晚期/无法手术的DTC的初步经验。这种方法在9例患者中成功使肿瘤降期,6例患者得以顺利进行R0手术,保留了重要器官功能,并有可能延长生存期。
对于无法手术的甲状腺癌,治疗选择有限。研究者评估了在这种具有挑战性的情况下,新辅助使用全身性酪氨酸激酶抑制剂是否有助于分化型甲状腺癌的手术治疗。研究回顾了2018年至2023年间42例因乳头状、滤泡状和未分化甲状腺癌接受酪氨酸激酶抑制剂(TKIs)治疗的单中心病例,以确定通过多学科方案接受新辅助酪氨酸激酶抑制剂(达拉非尼/曲美替尼、仑伐替尼/帕博利珠单抗或单用仑伐替尼)治疗的分化型甲状腺癌患者。
9例分化型甲状腺癌患者(年龄49岁,范围19 - 80岁,5名女性,4名男性)接受了新辅助TKI治疗,目的是提高原发或复发/残留肿瘤的可切除性。所有患者均患有局部晚期疾病,被认为无法切除或切除会带来难以接受的并发症。6例患者出现远处转移(6例肺部、6例椎骨/中轴骨、1例胸骨)。肿瘤存在BRAF V600E突变(6例乳头状甲状腺癌)或RAS/TERT突变(2例滤泡状甲状腺癌)或NCOA4 - RET融合。大多数患者接受新辅助TKI治疗<6个月,数周内通过影像学检查和体格检查可见疗效。所有完成手术的患者均实现R0切除,无严重手术并发症,也无需切除呼吸消化道结构。新辅助TKI总体耐受性良好(4例轻微毒性反应,1例严重毒性反应导致治疗中断,但未影响手术)。有远处转移的个别患者继续接受辅助TKI治疗。术后中位随访2年,所有患者均存活,无新的局部复发。
新辅助TKI在将无法手术切除的分化型甲状腺癌降期以实现R0切除,同时避免不必要的手术并发症方面似乎极为有效。采用多学科方法并早期进行基因检测以指导个性化新辅助TKI至关重要。迫切需要开展前瞻性研究,以明确新辅助TKI在晚期甲状腺癌治疗中的潜在作用。
研究背景
对于改善晚期和/或无法手术的甲状腺癌(AdvTC)患者的生存率及生活质量,目前存在尚未满足的新疗法需求。未分化甲状腺癌(ATC)是这一问题最典型的例证。作为甲状腺癌中致死性最强且最为罕见的亚型,ATC在确诊时通常已处于4期,伴有迅速增大的颈部肿物及远处转移。它很少适合手术治疗,预期寿命仅4 - 6个月,极为渺茫。然而,这种未满足的需求在分化型甲状腺癌(DTC)和髓样甲状腺癌(MTC)中同样存在,这些癌症若表现为局部晚期疾病(LAD),会侵犯颈部关键的呼吸消化道及血管结构,伴或不伴有远处转移。对于这部分患者,长期生存率可能比ATC患者更乐观,但创伤性的手术治疗可能会遗留大量病灶,还会对生活质量造成严重不良影响。近100年来,对于分化型晚期甲状腺癌,尚无明确的治疗方法能够改变现有的治疗模式:即初始手术治疗,随后根据情况选择性地通过放射性碘(RAI)消融和/或外照射放疗(EBRT)进行放射治疗。因此,开发针对此类AdvTC初始治疗的创新方案,既明确又迫切。
在过去十年中,随着对甲状腺癌分子基础的深入了解,多种酪氨酸激酶抑制剂(TKIs)已获得美国食品药品监督管理局(FDA)批准,用于靶向血管生成或特定的致癌驱动因子,如BRAF、RET和ALK等。这些药物如今广泛用于碘难治性高分化转移性甲状腺癌的辅助治疗;抗BRAF的TKIs也用于晚期ATC的新辅助(NEO)治疗。然而,关于新辅助TKI用于分化型晚期甲状腺癌的数据稀缺,仍处于探索阶段。在本研究中,研究者报告了使用新辅助TKI治疗局部晚期/无法手术的DTC的初步经验。这种方法在9例患者中成功使肿瘤降期,6例患者得以顺利进行R0手术,保留了重要器官功能,并有可能延长生存期。
研究结果
概述:
9名患者接受了NEO - TKI治疗,其中6名使用达拉非尼/曲美替尼,1名使用仑伐替尼/帕博利珠单抗,2名仅使用仑伐替尼。目的是提高颈部疾病的可切除性,尽量减少残留癌以利于RAI,并为长期疾病控制提供最佳机会。表I总结了该队列患者的临床特征。这9名患者中有5名女性和4名男性,开始NEO - TKI治疗时的中位年龄为49岁(范围19 - 80岁)。6名患者在初次诊断时(2例为滤泡状甲状腺癌[FTC],4例为乳头状甲状腺癌[PTC])接受NEO - TKI治疗,3名患者是在既往初次手术不充分,3年内出现PTC残留/复发性疾病进展时接受治疗。所有患者均患有局部晚期疾病(LAD):颈部最大肿物的cT大小为8 ± 2.8cm(均值 ± 标准差),伴有肿大/融合的淋巴结病(7例)以及邻近重要结构受累(气管/食管[6例]、颈内静脉/锁骨下血管[2例]、胸骨[1例])。所有患者均被认为无法手术切除,或虽可切除但会伴有难以接受的并发症,例如在已知存在远处无法手术疾病的情况下,激进的手术操作会严重降低生活质量。6名患者出现远处转移,转移部位为肺(6例)、椎骨/中轴骨(6例)或胸骨(1例)。
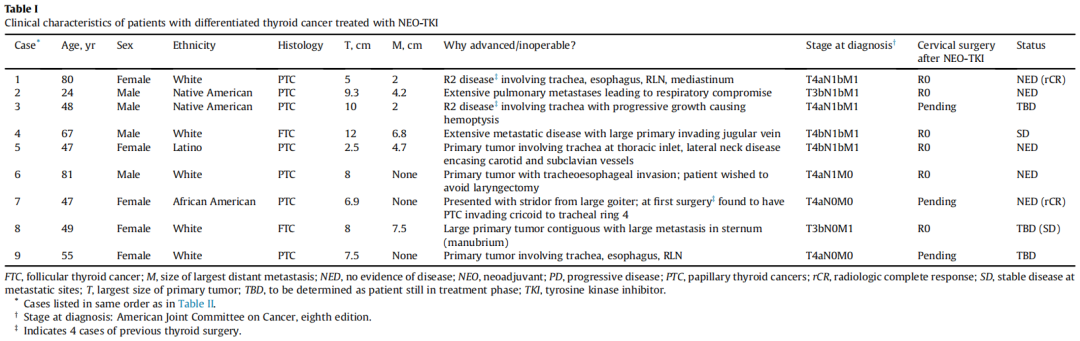
表I
新辅助治疗:
NEO - TKI治疗方案是根据肿瘤组织中检测出的突变情况来选择的。为尽快开始NEO - TKI治疗,相关检测被加急进行。基因分析在6/7例PTC中检测到BRAF V600E突变,在2例FTC病例中检测到NRAS/TERT或HRAS/TERT突变。两名患者基于活检标本的BRAF免疫组化结果开始使用NEO - TKI,随后经DNA测序确认。表II总结了与TKI相关的治疗细节及其他基因变异情况。总体而言,患者对NEO - TKI耐受性良好,仅有4例出现轻微毒性反应,需要中断用药或减少剂量;1例有冠心病病史的患者出现充血性心力衰竭,需暂停NEO - TKI治疗,但成功接受了手术。
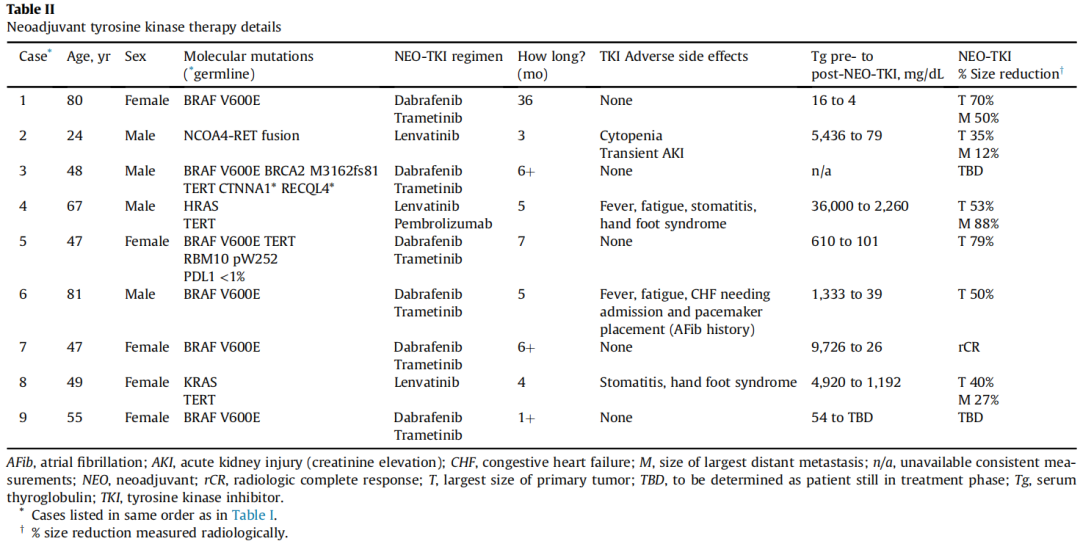
表II
大多数患者使用NEO - TKI的疗程为4 - 6个月,数周内便可见临床反应,包括肿物明显缩小以及气管受侵导致的咯血症状缓解。大多数患者在1 - 2周内报告“肿瘤缩小”,并感觉颈部肿物处有温热感,他们将此理解为“药物作用到了癌细胞”。大多数患者积极监测治疗效果,并记录症状日记。所有患者均依从治疗,无人因不良反应而提前停止使用NEO - TKI或要求更改治疗方案。
手术结果:
6名患者接受了初次或完整的甲状腺切除术,并进行了相应的中央区和侧颈部淋巴结清扫。1名患者(病例4,图1)需要进行颈内静脉节段性切除。所有接受手术的患者均实现了R0切除,无严重手术并发症,也无需切除呼吸消化道结构(喉、气管、食管)或喉返神经。没有出现声带麻痹、永久性低钙血症、血肿或手术相关感染的病例。患者在手术前至少10 - 14天停用TKI,且术中无与TKI相关的出血情况。3名患者正在等待手术:1名已安排手术时间,另外2名因新辅助TKI治疗出现影像学完全缓解(rCR),正在重新考虑是否进行完整手术。由于大多数手术的复杂性,需要两名或更多相关亚专科的主治医生(内分泌外科、头颈外科、整形外科、喉科)共同参与手术。据医生观察:(1)颈部肿物比初诊时更软、更小;(2)关键结构之间的组织层面能够被分离和暴露,因为肿瘤的浸润边缘回缩了;(3)通过耐心细致的解剖,喉返神经能够从邻近的癌组织中缓慢游离出来,并保留其功能;(4)明显的纤维组织增生反应包裹着缩小的肿瘤块,使密集的血管,包括甲状腺主要血管,变得模糊不清并相互交织。NEO-TKI治疗使5名患者达到rCR:3名伴有侧颈部淋巴结肿大,2名存在气管透壁浸润。由于在使用TKI之前未对任何肿大淋巴结进行活检,研究者不确定NEO-TKI是否使临床上肿大的淋巴结得以清除。因此,按照最初的手术计划进行了淋巴结切除。未来需要进一步研究,以确定rCR是否与病理CR相关,从而有可能像最近报道的接受NEO-TKI治疗的黑色素瘤患者那样,省略广泛的淋巴结清扫术。
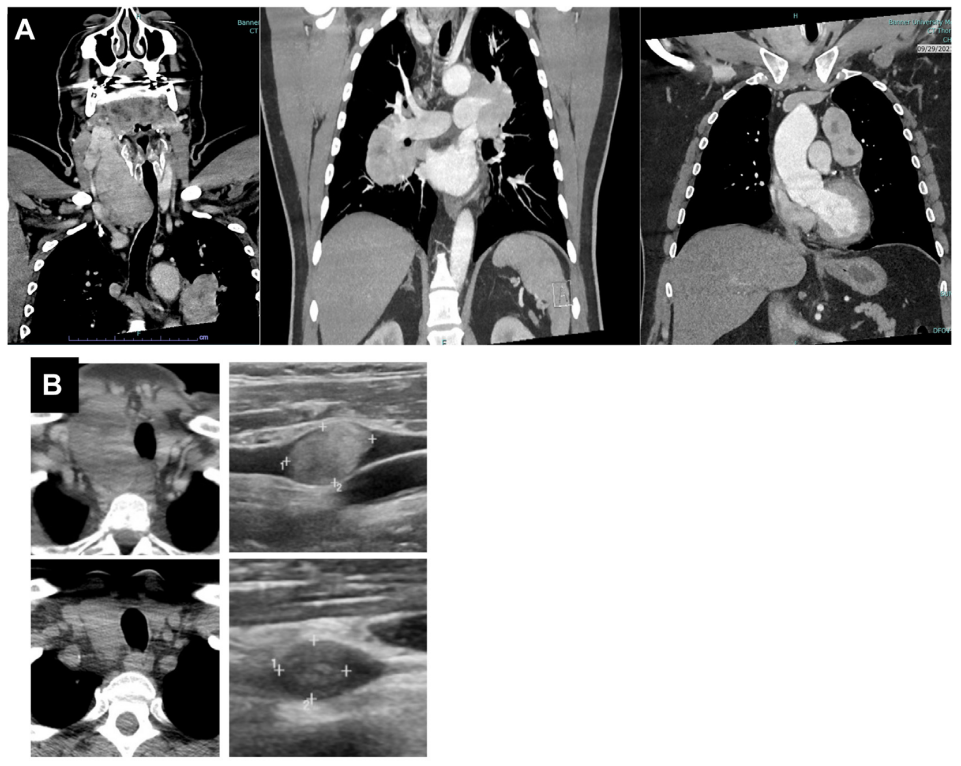
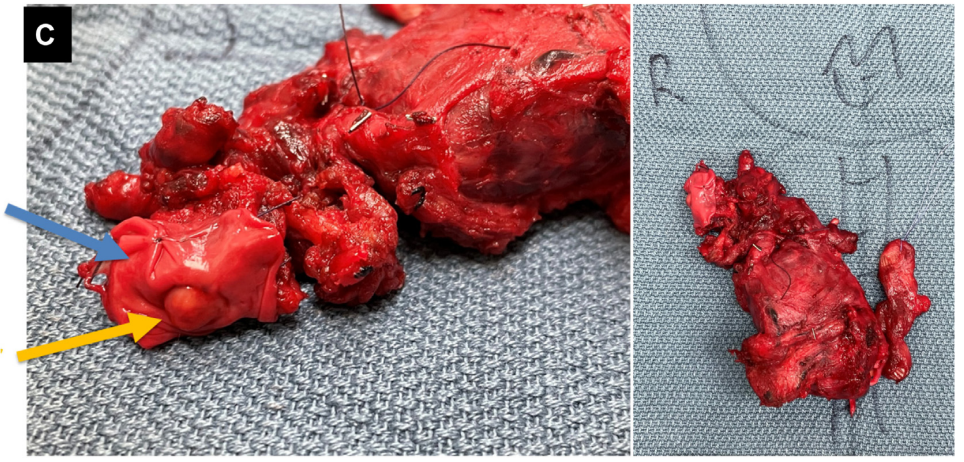

图1
结局:
所有患者对NEO - TKI治疗均有显著的PR,颈部原发性肿物平均缩小61%,最大转移病灶平均缩小44% 。所有患者都能够获得安排手术的转诊。两名有远处转移的患者继续接受辅助TKI治疗。中位术后随访2年,该NEO-TKI队列中的所有患者均存活,无新的局部复发。原发肿瘤组织学检查显示,整个组织样本中有坏死和玻璃样变区域,散在分布着少量存活的残留恶性细胞(图2)。尽管基于问卷调查的生活质量评估并非常规诊疗的一部分,但研究者始终会询问患者在治疗期间及治疗结束时的感受。他们对NEO - TKI治疗方案并无太大担忧,庆幸能够避免原本建议的根治性手术,并对采用NEO - TKI治疗的共同决策过程表示认可。几乎所有患者都因社会经济因素而在获得治疗或开始治疗的时间上受到影响;一半患者因完全没有医疗保险或保险不涵盖TKI药物,需要药房申请慈善用药。
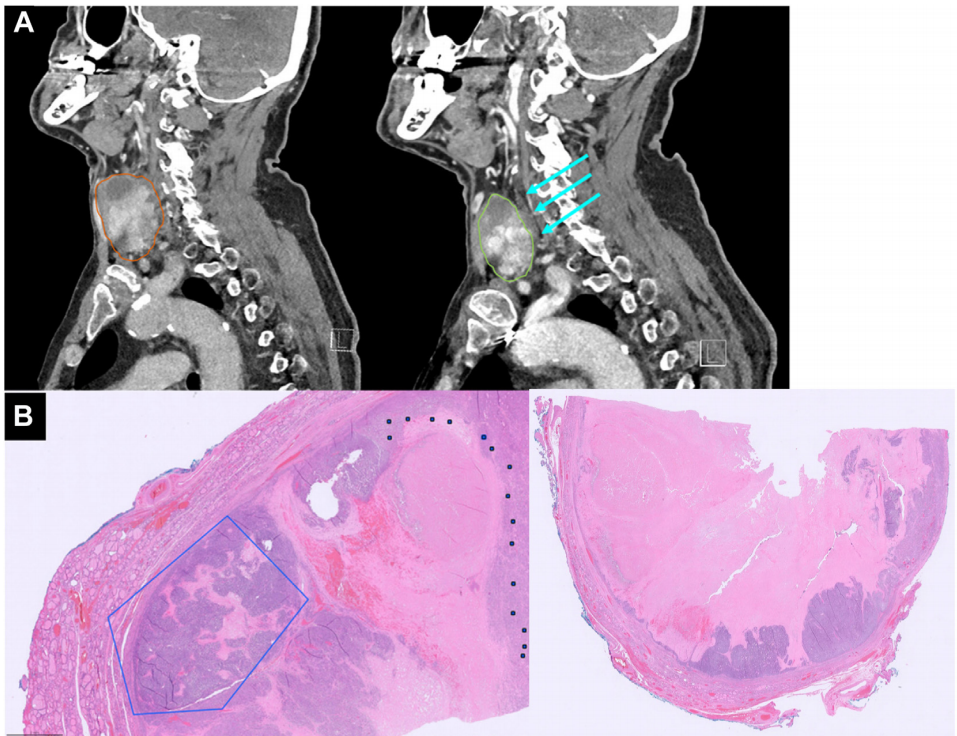
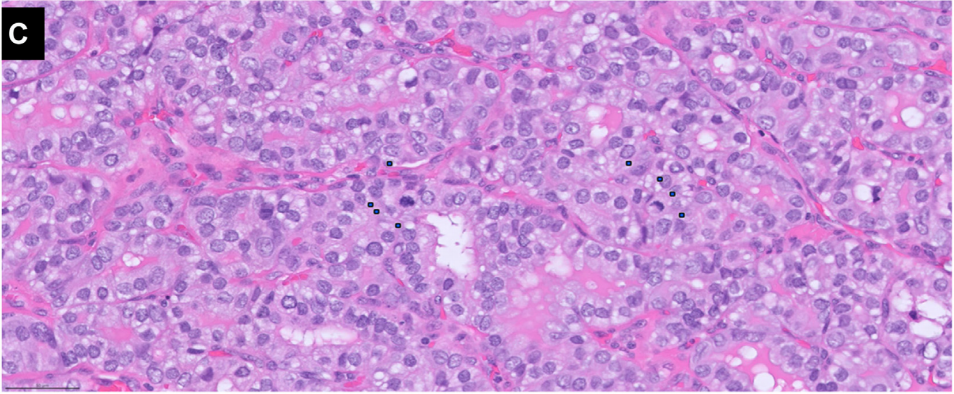

图2
医疗的社会决定因素:
该研究队列在许多方面具有多样性,并且代表了AdvTC患者的范围。在首批使用NEO - TKI治疗DTC的患者中,男女比例相当。患者种族包括白人(5例)、非裔美国人(1例)、拉丁裔(2例)和美洲原住民(2例)。患者年龄范围从19岁到80岁,这使得能够观察在不同健康状况和共患疾病情况下患者对TKI的耐受性。尽管队列规模太小,无法得出广泛的一般性结论,但可以合理地说,不同类型的患者对TKI的耐受性普遍良好。
患者的社会经济背景也差异巨大,从没有保险、教育程度不高且英语不流利的人群,到职业歌手和受过大学教育的教授都有。难以确定阻碍患者获得治疗的常见因素。在同一时期还遇到两名未纳入本队列的患者,他们有着特殊的限制因素:一位是囚犯,另一位是未进行社保登记的墨西哥移民劳工。由于他们没有其他健康问题,且后续无法联系以了解病情进展,推测两人均已死于AdvTC。其中一名患者的FTC广泛转移至胸骨、脊柱和脑部,同时伴有局部晚期颈部淋巴结肿大,导致舌下神经麻痹。在其住院期间,根据国家监管规定,无法以住院用药的形式开启口服TKIs治疗。在社区医疗实践、监狱医疗保健机构,甚至许多学术医疗中心中,具备甲状腺癌(任何情况下)TKI治疗经验的肿瘤学家和药剂师仍然稀缺。
讨 论
尽管局部晚期甲状腺癌并不常见,但它对所有相关临床医生来说都是巨大的治疗挑战。传统上,手术一直是甲状腺癌成功治疗的主要手段,而且往往是唯一手段。然而,对于LAD病例,手术可能无法充分清除病灶,甚至根本无法进行。理想情况下,应首先进行全甲状腺切除术,可同时进行或不进行颈部清扫,以尽可能切除或减少原发性肿瘤,为术后RAI创造条件,几乎所有LAD患者都适合且能从RAI中获益。挑战在于,要在不牺牲周围关键器官及其功能的前提下,实现疾病的完全(R0)或充分(R1)清除,以便进行RAI。大量残留病灶(R2)可能需要EBRT来更好地控制局部病情。尽管采用了最佳治疗策略,针对LAD的初始手术治疗仍会导致高发病率,且癌症特异性死亡率会高出10倍。要在这类复杂患者群体中实现更好的疾病管理和治疗效果,不能仅依赖过去几十年最精良的手术改进,而需要一种全新的治疗模式。
肿瘤学中的新辅助系统治疗(NEO)最初在局部晚期乳腺癌治疗中开创先河,近年来已成为多种肿瘤类型的标准治疗方案。新辅助治疗的优势包括缩小肿瘤体积、提高肿瘤可切除性,以及新辅助免疫治疗可延长生存期。不幸的是,NEO在分化型AdvTC中尚未得到充分研究,这主要是由于系统治疗选择有限,且传统化疗药物在转移性病例中效果不佳。与其他实体瘤恶性肿瘤相比,分化型AdvTC仍被视为“孤儿”或罕见疾病。因此,直到2012年,美国FDA才首次批准专门用于甲状腺癌的系统治疗药物,即用于MTC的卡博替尼。随着对甲状腺癌分子特征的深入了解,多种新的系统治疗药物已获批用于碘难治性DTC,以及由BRAF、RET和ALK驱动的甲状腺癌。免疫治疗和抗BRAF治疗也已获批用于部分ATCs。
只有少数病例研究阐述了这种新型NEO-TKI治疗DTC的早期经验。索拉非尼作为新辅助治疗药物,首次被报道用于治疗无法切除的PTC,结果患者呼吸症状改善,肿瘤体积显著缩小,得以进行全甲状腺切除术,随后通过RAI实现了长期疾病控制。有类似病例报道使用仑伐替尼,14个月后,患者能够进行R0手术切除(全甲状腺切除术和中央区颈部淋巴结清扫术),且无肉眼可见的残留病灶。在一组8例晚期MTC患者中,舒尼替尼被用作诱导治疗;半数患者达到PR,2例患者成功接受了手术切除。相比之下,一些中心对NEO-TKI治疗ATC的经验报道更为丰富。在一份病例报告中,最初使用达拉非尼/曲美替尼,疾病进展后加用帕博利珠单抗;患者达到部分缓解,接受了手术切除,随后进行放化疗。在一组4例ATC患者中,同样使用达拉非尼/曲美替尼或仑伐替尼/帕博利珠单抗,1例患者在NEO-TKI治疗后能够接受手术。休斯顿MD安德森癌症中心治疗的最大一组57例ATC患者显示,新辅助BRAF靶向治疗使70%的病例肿瘤缩小、手术并发症减少且手术范围整体缩小。该中心最近的一份报告强调,5例ATC患者在NEO-TKI治疗后声带功能得到恢复。这些病例报告/系列研究展示了新辅助治疗的早期成功尝试,为回顾DTC患者的治疗经验奠定了坚实基础。
本综述探讨了治疗局部晚期和/或无法手术的甲状腺癌(尤其是DTC)这类极其复杂患者所面临的严峻挑战。完成NEO - TKI治疗的6名患者均符合手术条件,并成功实现了R0切除。根据定期影像结果,预计仍在接受治疗的其余3名患者也会如此。值得注意的是,没有出现严重的手术或与TKI相关的并发症。组织学检查显示肿瘤有明显坏死,这归因于NEO - TKI的治疗效果。肿瘤学和功能学方面的结果均超出了最初的预期或预测。
作为一项回顾性研究及非随机病例系列分析,对该患者队列的回顾存在一些局限性。要确定本机构在NEO - TKI可用之前的历史对照患者组难度较大。就目前情况而言,诸如纪念斯隆·凯特琳癌症中心等机构描述传统喉气管重建(LAD)治疗的同期系列研究,可能提供了最具参考价值的预期对比结果。值得注意的是,即便在这个大型转诊中心,AdvTC的发病率也很低(每年少于10例),这表明该疾病确实并不常见。这可能会给未来的随机试验带来阻碍。目前,关于临床试验结果且累计纳入接受NEO - TKI治疗的DTC患者<50例的文献极少。近期的研究来自亚洲和欧洲,不过北美尚无此类公开数据。此外,鉴于传统治疗方案存在的发病风险,患者可能会选择退出此类试验。在这种情况下,共同决策原则和价值一致的医疗照护就显得尤为重要。最后,用于新辅助治疗的药物尚未获得美国FDA的批准,因此属于超说明书用药。
尽管这只是一个由9名患者组成的相对较小的队列,但本研究仍是北美迄今为止所报道的关于NEO - TKI治疗DTC后手术结果的最大规模经验总结。在本研究中,NEO - TKI的作用是使基本上所有患者的晚期颈部疾病都能通过手术切除。NEO - TKI显著缩小了原发部位的整体肿瘤大小,避免了疾病引发的严重局部并发症(咯血、气道梗阻)。这种方法在转移部位也取得了极好的疾病反应,推迟了一些患者即将到来的死亡时间,同时在迄今纳入的所有患者中保持了较好的生活质量。此外,在大多数病例中,成功的手术切除使得RAI得以有效应用,避免了持续使用TKI以及繁琐的监测,从而提升了生活质量。长期复发率和生存率仍有待观察,但在术后中位2年的随访中,所有患者均存活,无局部区域复发,且远处疾病稳定或消失。TKIs在让碘难治性疾病重新对碘敏感,从而得以后续进行RAI方面所起的作用(比如病例3),值得关注。尽管深入讨论这一点超出了本文范围,但这突显了TKI能够从多种途径改善AdvTC治疗效果。这种新型的治疗模式有望从根本上改变局部侵袭性和晚期分化型及未分化型甲状腺癌的预后和结局,值得进一步研究。
精准肿瘤学是现代肿瘤学实践的标志。在本病例系列中,所有治疗决策都根据每位患者的独特情况进行了个体化制定。在将NEO - TKI疗法应用于AdvTC时,不存在 “一刀切”的方案。基于经验和文献综述,研究者提出以下流程来指导晚期DTC/ATC的新辅助治疗(图3)。希望在该领域获得可靠的前瞻性数据之前,这个流程能推动采用多学科方法来治疗这一具有挑战性的AdvTC患者群体。
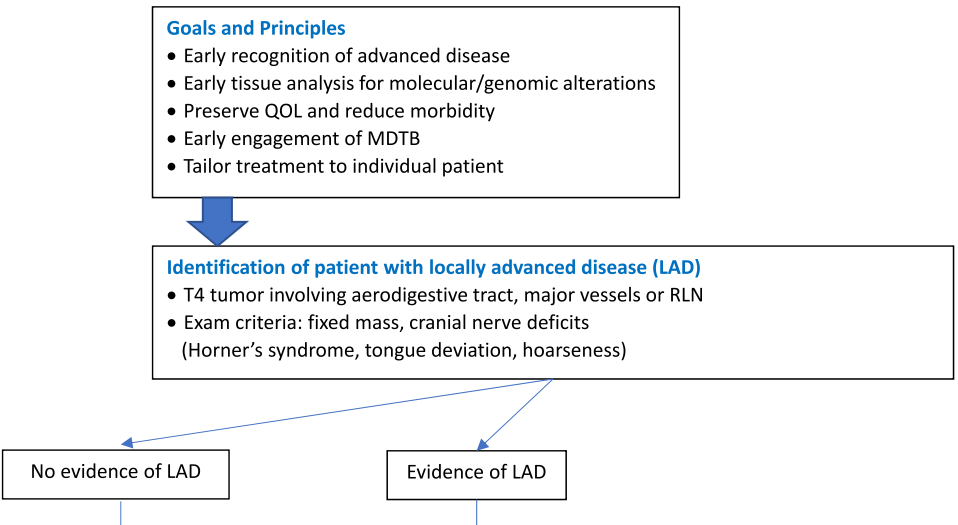
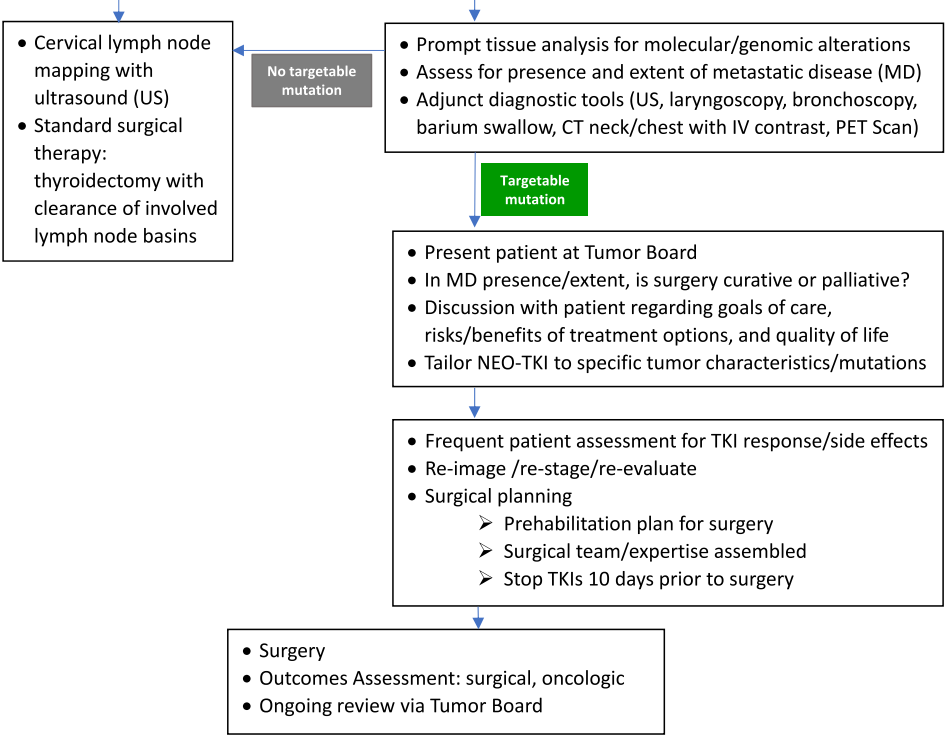
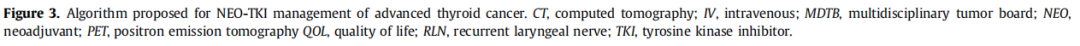
图3
总之,根据经验,本研究强调了NEO - TKI疗法的显著益处,并针对局部晚期/无法手术的分化型甲状腺恶性肿瘤提出了一种新的治疗模式。多项使用多种药物的前瞻性研究正在进行中,以证实这种方法的有效性,并更好地确定合适的患者群体。期待这些研究结果,因为它们很可能为晚期甲状腺癌的治疗指明未来方向。
参考文献:
Dickerson K, Milas M, Metzger R, et al. Neoadjuvant systemic therapy for inoperable differentiated thyroid cancers: Impact on tumor resectability. Surgery. 2025;177:108836. doi:10.1016/j.surg.2024.08.0468

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#甲状腺癌# #基因检测#
30