【论著】|261例局限期食管小细胞癌患者的临床、预后及治疗模式分析
2025-07-12 中国癌症杂志 中国癌症杂志 发表于上海
本文旨在了解其生存状态、预后因素及失败模式,分析其治疗模式,从而为LS-SCEC患者的临床预后判断和治疗决策提供数据支撑。
[摘要] 背景与目的:局限期(limited-stage,LS)-食管小细胞癌(small cell esophageal carcinoma,SCEC)恶性程度高、患者预后极差,由于其罕见性,目前无特异性分期,亦无法通过设计随机对照临床试验来指导治疗,很多临床经验是借鉴于相对成熟的小细胞肺癌(small cell lung cancer,SCLC)治疗体系,然而患者预后仍较差,疗效始终无法突破。本研究旨在分析LS-SCEC患者的生存及预后因素、失败模式,并探讨其治疗策略。方法:回顾性分析2006年1月—2023年6月于复旦大学附属肿瘤医院确诊并接受治疗的原发性LS-SCEC患者的病例资料,具备诊断、分期、随访所需的临床资料。小细胞癌成分并非主要成分(<50%)的混合型食管肿瘤患者不纳入本研究。所有计数资料采用频数和百分比进行统计描述,计量资料采用x±s进行统计描述。分类变量采用χ2检验或Fisher确切概率法进行组间比较。生存分析应用Kaplan-Meier法,采用COX回归分析影响预后的相关因素,采用1∶1最近邻匹配法分析根治性放化疗组患者与根治性手术联合术后辅助化疗组患者的生存差异。P<0.05为差异有统计学意义。结果:261例符合要求的LS-SCEC患者纳入本研究,中位随访时间为72.7个月(95% CI:52.0~92.4),中位癌症特异性生存(cancer-specific survival,CSS)为24.5个月(95% CI:19.7~29.3),5年CSS率为32.8%;中位无进展生存(progression-free survival,PFS)为12.0个月(95% CI:10.7~13.3)。未复发患者67例,可统计到首次治疗失败模式的患者169例,远处转移是最常见的复发模式,首次治疗失败模式中有远处转移的患者为131例(77.5%),局部区域复发患者仅38例(22.5%)。最常见的远处转移器官是肝(54例),其次是骨(25例)、脑(24例)及肺(23例)。化疗周期数和TNM分期(第8版)是LS-SCEC患者CSS和PFS的独立预后因素。本研究进一步比较了接受根治性手术联合术后辅助化疗患者与接受根治性放化疗患者的预后,发现倾向性匹配前后的CSS和PFS差异均无统计学意义(P>0.05),而肿瘤位于颈段及胸上段、长度更长、分期更晚的患者更倾向于接受放化疗,且放化疗组接受≥4个周期化疗患者比例更高。结论:本研究是一项LS-SCEC较大样本、数据较全面细致且随访时间较长的回顾性分析。接受根治性放化疗与根治性手术+辅助化疗患者的CSS和PFS差异均无统计学意义,接受≥4个周期化疗患者的获益更大。SCEC远处转移风险高且呈高度异质性,LS-SCEC的治疗应注重个体化。
[关键词] 食管小细胞癌;局限期;失败模式;预后;治疗
[Abstract] Background and purpose: Limited-stage (LS)-small cell esophageal carcinoma (SCEC), characterized by high aggressiveness and an extremely poor prognosis, lacks standardized staging systems due to its rarity. Consequently, no randomized controlled clinical trials exist to guide therapeutic strategies, necessitating reliance on extrapolated protocols from small cell lung cancer (SCLC) paradigms, though clinical outcomes remain dismal. This study aimed to analyse survival outcomes, prognostic factors, failure patterns and therapeutic strategies in patients with LS-SCEC. Methods: We conducted a retrospective single-center study of LS-SCEC patients diagnosed and treated at Fudan University Shanghai Cancer Center from January 2006 to June 2023. Clinicopathological data for diagnosis, staging and follow-up were rigorously collected. Patients with mixed esophageal tumors in whom small cell carcinoma was not the predominant histological component (<50%) were excluded. Continuous variables were presented as x±s. Categorical variables were summarized as counts and percentages, with intergroup comparisons performed using χ2 test or Fisher’s exact tests. Survival analysis was performed using the Kaplan-Meier method, and Cox regression was used to analyse factors related to prognosis. A two-sided P<0.050 was considered statistically significant. A 1∶1 nearest-neighbour propensity score matching was applied to compare survival outcomes between patients undergoing radical chemoradiotherapy and those receiving radical surgery followed by adjuvant chemotherapy. Results: Of 261 eligible LS-SCEC patients included, the median follow-up duration was 72.7 months (95% CI: 52.0-92.4), with a median cancer-specific survival (CSS) of 24.5 months (95% CI: 19.7-29.3) and a 5-year CSS rate of 32.8%. The median progression-free survival (PFS) was 12.0 months (95% CI: 10.7-13.3). Among these, 67 patients remained recurrence-free, and 169 patients exhibited disease progression after first-line treatment. Distant metastasis was the predominant recurrence pattern (131 patients, 77.5%), whereas locoregional recurrence occurred in only 38 patients (22.5%). The most frequent metastatic sites were liver (54 patients), followed by bone (25 patients), brain (24 patients), and lung (23 patients). The number of chemotherapy cycle and TNM stage (8th edition) were independent prognostic factors for CSS and PFS in LS-SCEC patients. Comparative analysis of radical surgery with adjuvant chemotherapy versus radical chemoradiotherapy revealed no statistically significant differences in CSS and PFS (P>0.05), even after propensity score matching. Patients with cervical/upper thoracic tumors, longer tumor lengths, and advanced stages were more likely to receive chemoradiotherapy; additionally, the chemoradiotherapy group had a higher proportion of patients completing ≥4 chemotherapy cycle. Conclusion: This large-sample retrospective study with comprehensive datasets and long-term follow-up demonstrated comparable survival outcomes between radical chemoradiotherapy and radical surgery plus adjuvant chemotherapy for LS-SCEC. A minimum of 4 chemotherapy cycle was associated with improved prognosis. SCEC is associated with a high risk of distant metastasis and marked heterogeneity. Therefore, the treatment of LS-SCEC should prioritize an individualized approach.
[Key words] Small cell esophageal carcinoma; Limited-stage; Failure pattern; Prognosis; Treatment
食管癌是世界范围内常见的恶性肿瘤之一,发病率在全球恶性肿瘤中排名第8位,死亡率排名第6位[1]。小细胞癌恶性程度高,患者预后差,最常见于肺部,仅2.5%~4.1%发生在肺外器官[2],肺外小细胞癌几乎在每个系统都可见,消化道是肺外小细胞癌第二高发部位,其中又以食管小细胞癌(small cell esophageal carcinoma, SCEC)多见。原发性SCEC由Mckeown[3]在1952年首次描述,占同期食管癌的0.5%~ 3.8%[4-6],占全身神经内分泌肿瘤的1%。虽然SCEC比食管鳞癌和食管腺癌更为罕见,但SCEC在世界范围内发病率有逐年升高的趋势[7-8],国内报道的病例明显多于国外。SCEC虽然影像学所见及临床症状与食管鳞癌及食管腺癌并无明显差异,但其生物学特性与上述两者存在巨大差异[9-10]。SCEC呈浸润性生长,原位癌或上皮内癌罕见;恶性程度高,生长快,侵袭性强,淋巴及血行转移较早,很容易成为全身性疾病,病程短,预后极差,局限期(limited-stage,LS)-SCEC患者的5年生存率仅7.9%~18.0%,广泛期-SCEC患者的5年生存率几乎为零[11-12]。
既往关于LS-SCEC治疗策略的研究多基于病例报道和小样本的回顾性研究,仍缺乏大样本多中心研究,随机对照临床试验短期内难以开展,因而对其治疗方案的选择尚无统一标准。随着对SCEC关注度的逐渐提升,临床上亟待明确以大样本该疾病病例为基础的预后因素和治疗策略。手术对LS-SCEC患者的短期生活质量和长期生存有着深远影响,有研究[13-14]认为SCEC是全身性疾病,化放疗是LS-SCEC的最优治疗手段。但也有研究认为手术参与的LS-SCEC患者预后可能更优[15-16]。多学科综合治疗已成为LS-SCEC主要的治疗模式[5,16-19],但既往研究并没有就局部治疗得出一致意见,最佳的治疗组合方式尚无定论。此外,免疫治疗已改变了目前的临床实践,免疫治疗联合化疗用于局部晚期SCEC新辅助治疗的价值仍有待进一步探讨。因此,本文回顾性分析2006年1月—2023年6月于复旦大学附属肿瘤医院确诊并接受治疗的原发性LS-SCEC患者的病例资料,旨在了解其生存状态、预后因素及失败模式,分析其治疗模式,从而为LS-SCEC患者的临床预后判断和治疗决策提供数据支撑。
1 资料和方法
1.1 病例来源
本研究纳入2006年1月—2023年6月经复旦大学附属肿瘤医院确诊及治疗的原发性LS-SCEC患者。纳入标准:① 年龄≥18岁;② 小细胞癌成分为主要成分(≥50%);③ 具备诊断、分期、随访所需的临床资料。排除标准:① 所需资料和随访信息不全者;② 失访6个月以上者。
SCEC的病理学诊断标准为:
① 光学显微镜下,形态学符合小细胞癌形态特征:细胞呈圆形、卵圆形或短梭形小细胞,片状、巢状分布,细胞质较少,核大而浓密,颗粒状核染色质,具有较多核分裂象,核仁模糊不清;② 免疫组织化学染色:具备上皮性肿瘤生物学特征,同时表达一个或多个神经内分泌标志物(CD56、CgA、Syn、INSM1)。1例SCEC标本的组织病理学特征及免疫组织化学染色详见图1。
参考美国退伍军人纪念医院肺癌研究组(Veteran’s Administration Lung Cancer Study Group,VALSG)分期标准,LS定义为肿瘤局限于食管及食管周围组织,伴或不伴有区域淋巴结转移,病变可被一个照射野所包含;仅锁骨上淋巴结转移也归为LS。本研究进一步使用美国癌症联合会(American Joint Committee on Cancer, AJCC)第8版食管癌TNM分期标准对LS-SCEC患者进行分期。根据世界卫生组织(World Health Organization,WHO)定义,一生中连续或累积吸烟6个月或以上者定义为吸烟者。重度饮酒定义为≥30 g/d[20]。不良饮食习惯包括喜食高温及腌制食物[21]。本研究已获得复旦大学附属肿瘤医院医学伦理委员会的批准(伦理编号:2202251-5)。
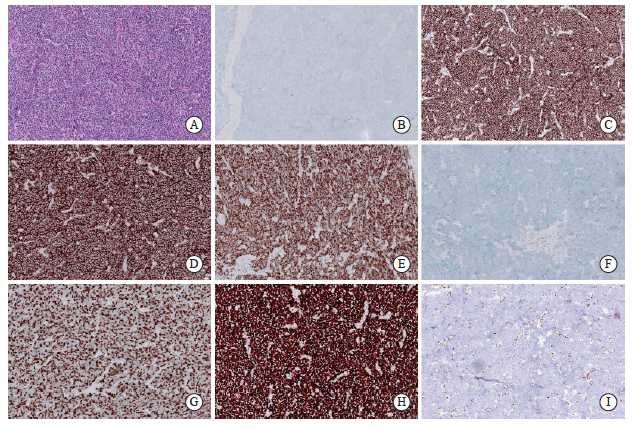
图1 1例SCEC标本的组织病理学特征及免疫组织化学染色(×200)
Fig. 1 Histopathological features and immunohistochemical staining of an SCEC specimen (×200)
A: SCEC (H-E staining); B: CgA negative (Envision); C: Syn positive (Envision); D: CD56 positive (Envision); E: INSM1 positive (Envision); F: p40 negative (Envision); G: Ki-67 80% (Envision); H: diffusely strong p53 positivity (Envision); I: Rb1 negative (Envision).
1.2 结局和随访
癌症特异性生存(cancer-specific survival,CSS)是指从治疗开始至因肿瘤相关原因引起死亡的时间。无进展生存(progression-free survival,PFS)是指从治疗开始到复发、转移或死亡的时间,以先发生者为准。
在疗效评估方面,基于实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1[22],通过临床影像学检查结果及基线肿瘤标志物等进行评估,并且在治疗期间保证每3~4周进行1次相关检查。
患者在治疗结束后,前2年每3个月进行1次随访,第3~5年每6个月进行1次随访,此后每年1次。随访资料通过以下3种方式收集:病史查阅、电话随访和死因数据链接。随访截至2024年6月30日或患者死亡。
1.3 统计学处理
本研究的所有数据均采用SPSS 26.0软件进行录入及统计分析,采用GraphPad软件作图。所有计数资料采用频数和百分比(%)进行统计描述,所有计量资料采用x±s进行统计描述。连续变量采用t检验进行组间均数的比较,分类变量采用χ2检验或Fisher确切概率法进行组间比较。以根治性放化疗组为基准,采用1∶1最近邻匹配法与根治性手术联合辅助化疗组进行匹配。生存分析采用Kaplan-Meier法,生存率比较采用log-rank方法检验,以危险比(hazards ratio,HR)及其95% CI表示。使用X-tile 3.6.3软件获取连续变量的最佳临界值并进行分类变量的转化。采用COX回归分析影响预后的相关因素,单因素分析中满足条件的参数或临床上有意义且不存在共线性的自变量将被纳入多因素COX回归模型中进行分析,探索LS-SCEC的独立预后因素。采用双侧检验,P<0.050为差异有统计学意义。
2 结 果
2.1 患者的临床病理学特征
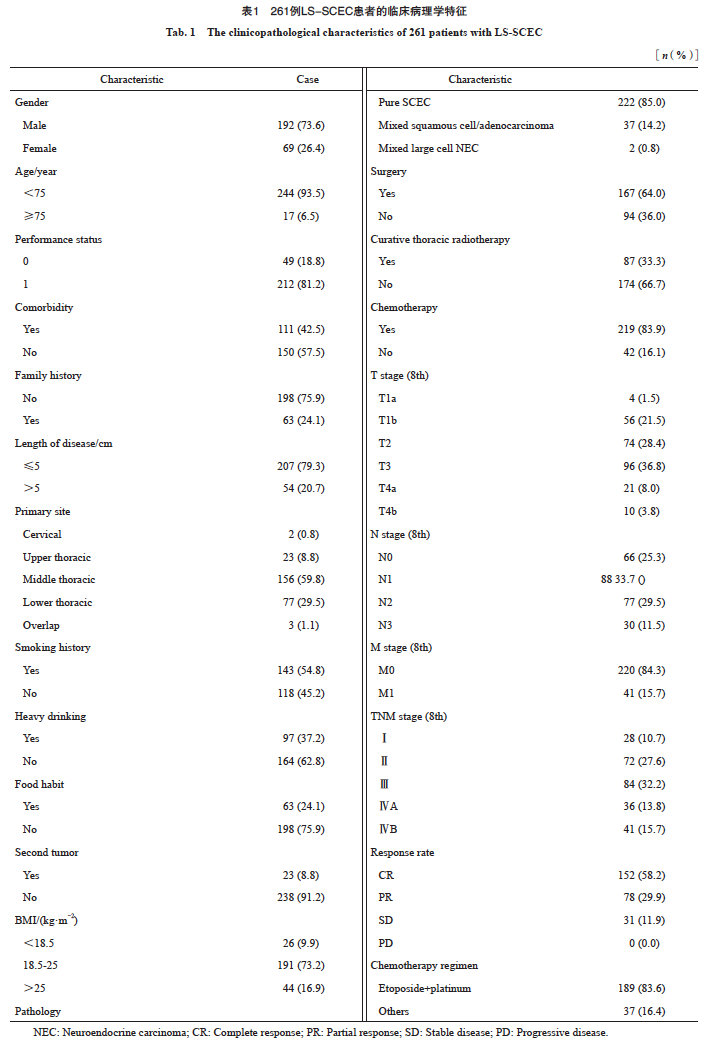
患者纳入和排除标准流程图见图2。最终纳入261例LS-SCEC患者,其临床病理学特征见表1。患者多为男性(192例,73.6%)、吸烟(143例,54.8%)、年龄<75岁(244例,93.5%)、体重指数(body mass index,BMI)18.5~25.0 kg/m2(191例,73.2%)、胸中下段(胸中段156例,59.8%;胸下段77例,29.5%)、体力状态评分为1分(212例, 81.2%),患者多无家族史(198例,75.9%)、无第二原发肿瘤(238例,91.2%),混合其他病理学类型患者39例(混合鳞癌33例,混合腺癌3例,混合腺鳞癌1例,混合大细胞神经内分泌癌2例)。患者多为T3期(96例,36.8%)及T2期(74例,28.4%),初治多伴有区域淋巴结转移(195例,74.7%),其中N1期患者88例(33.7%),N2期患者77例(29.5%), N3期患者30例(11.5%)。肿瘤长度平均为(3.8±2.0)cm,最短0.3 cm,最长11.0 cm,多数≤5 cm(207例,79.3%)。根据AJCC第8版食管癌TNM分期标准,Ⅲ期患者最多,为84例(32.2%),Ⅱ期患者72例(27.6%),ⅣB期患者41例(15.7%),ⅣA期患者36例(13.8%), Ⅰ期患者仅28例(10.7%)。
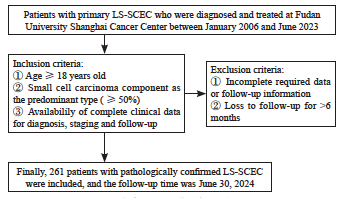
图2 患者纳入和排除标准流程图
Fig. 2 Flowchart of patient inclusion and exclusion criteria
2.2 生存及失败模式
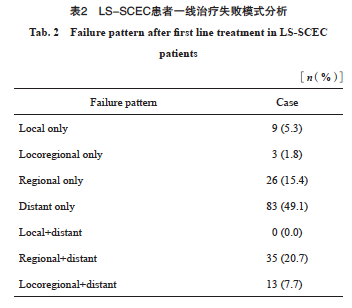
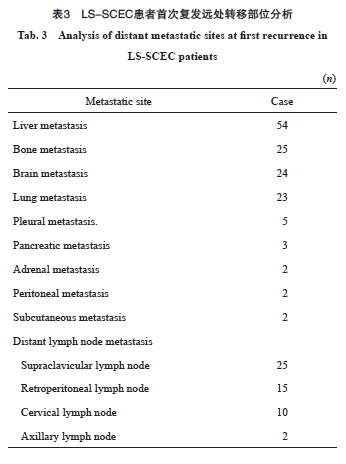
截至2024年6月30日,中位随访时间72.7个月(95% CI:52.0~92.4),存活患者93例,因肿瘤及肿瘤并发症死亡患者158例,10例患者因非肿瘤相关因素死亡。中位CSS为24.5个月(95% CI:19.7~29.3),1年CSS率为83.9%,3年CSS率为37.7%,5年CSS率为32.8%。未复发患者为67例,中位PFS为12.0个月(95% CI:10.7~13.3),1年PFS率为49.2%,3年PFS率为23.7%,5年PFS率为21.3%。本研究可统计到首次治疗失败模式的患者169例(87.1%,表2)。研究结果提示,远处转移是LS-SCEC最常见的失败模式,失败模式中仅为远处转移的患者为83例(49.1%),首次治疗失败模式中有远处转移的患者为131例(77.5%),局部区域复发患者仅为38例(22.5%)。LS-SCEC患者常见的远处转移部位见表3,其中肝是最常见的远处转移器官(54例),其次是骨(25例)、脑(24例)、肺(23例)。
2.3 预后因素
2.3.1 CSS预后因素
单因素分析显示,肿瘤长度、肿瘤位置、病理学类型、化疗周期数、第8版分期(T分期、N分期、M分期和总分期)与CSS有关(表4)。进一步多因素分析发现,化疗周期数和总分期是CSS的独立预后因素,具体生存数据及统计学参数见表5和图3。
2.3.2 PFS预后因素
单因素分析提示,病理学类型、化疗周期数、第8版分期(T分期、N分期和总分期)与PFS有关(表6)。进一步多因素分析发现,化疗周期数和总分期是PFS的独立预后因素,具体生存数据及统计学参数详见表5和图4。
2.4 治 疗
2.4.1 治疗情况概述
167例(64.0%)患者行手术治疗,包括153例根治性手术和14例姑息性手术。根治性手术患者中27例(10.3%)仅行手术治疗,其中4例因术后吻合口瘘未行后续辅助治疗,10例因术后一般状况未恢复未行后续辅助治疗。110例(42.1%)患者术后行化疗和化放疗,以术后辅助化疗居多(91例)。16例(6.1%)患者行新辅助治疗后手术,8例行紫杉醇+铂类药物联合程序性死亡蛋白-1(programmed death-1,PD-1)单抗新辅助治疗,其中1例新辅助化疗联合免疫治疗3个周期后肿瘤无明显退缩,后行新辅助放疗40 Gy/20次达到病理学完全缓解(pathological complete response,pCR),其余新辅助化疗联合免疫治疗的患者肿瘤退缩分级(tumor regression grade,TRG)为1和2级各1例,3级5例。8例患者仅行新辅助化疗,6例使用依托泊苷联合铂类药物方案,其中2例达到pCR,其余2级1例, 3级3例。14例行姑息性手术患者中13例行术后辅助化疗,其中4例亦行术后辅助放疗。LS-SCEC患者的非手术治疗模式包括:放化综合治疗81例(31.0%),CR 2例,部分缓解(partial response,PR)58例,疾病稳定(stable disease,SD)21例,有效率为74.1%;单纯化疗7例(3.2%),CR 1例,PR 3例,SD 3例;单纯放疗6例(2.3%),CR 1例,PR 1例,SD 4例。
姑息性手术组患者的中位PFS为6.4个月(95% CI:4.0~8.8),中位CSS为14.0个月(95% CI:8.5~19.5)。单纯化疗组患者的中位PFS为15.0个月(95% CI:7.3~22.7),中位CSS为16.0个月(95% CI:10.8~21.2)。单纯放疗组患者的中位PFS为7.7个月(95% CI:0.0~18.9),中位CSS为19.0个月(95% CI:3.8~34.2)。单纯手术组患者的中位PFS为6.9个月(95% CI:3.7~10.1),中位CSS为17.9个月(95% CI:0.6~35.2)。放化综合治疗组患者的中位PFS为11.6个月(95% CI:8.2~15.0),中位CSS为15.0个月(95% CI:18.8~33.8)。根治性手术+辅助化疗组患者的中位PFS为14.2个月(95% CI:11.2~17.2),中位CSS为31.0个月(95% CI:22.7~39.2)。根治性手术+辅助化放疗组患者的中位PFS为12.9个月(95% CI:10.0~15.8),中位CSS为19.3个月(95% CI:16.5~22.1)。新辅助治疗+根治性手术组患者的中位PFS为13.0个月(95%CI:7.9~18.1),中位CSS为26.0个月(95% CI:15.2~36.8)。姑息性手术组与根治性手术+辅助化疗、放化综合治疗组的PFS和CSS差异均有统计学意义(P<0.05)。单纯手术组与根治性手术+辅助化疗、放化综合治疗组的PFS差异均有统计学意义(P=0.001、0.003)。单纯手术组与根治性手术+辅助化疗组的CSS差异均有统计学意义(P=0.047)。
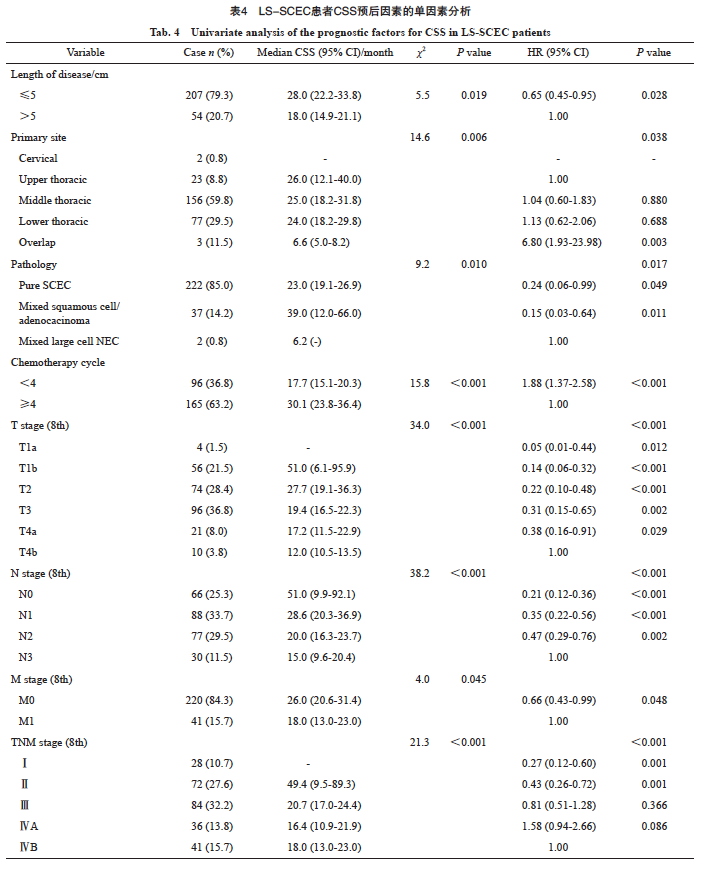
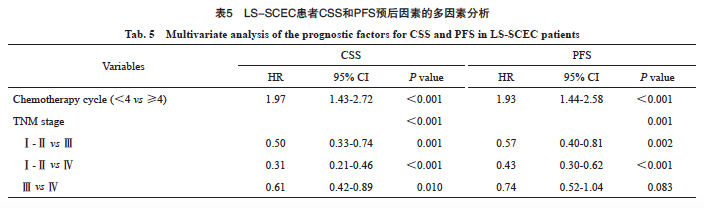
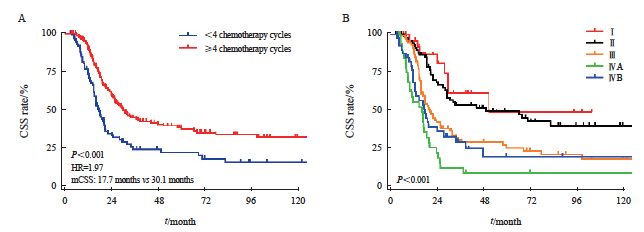
图3 LS-SCEC患者化疗周期和分期对CSS的影响
Fig. 3 Impact of chemotherapy cycles and stage on CSS in LS-SCEC patients
A: Chemotherapy cycle; B: Stage.
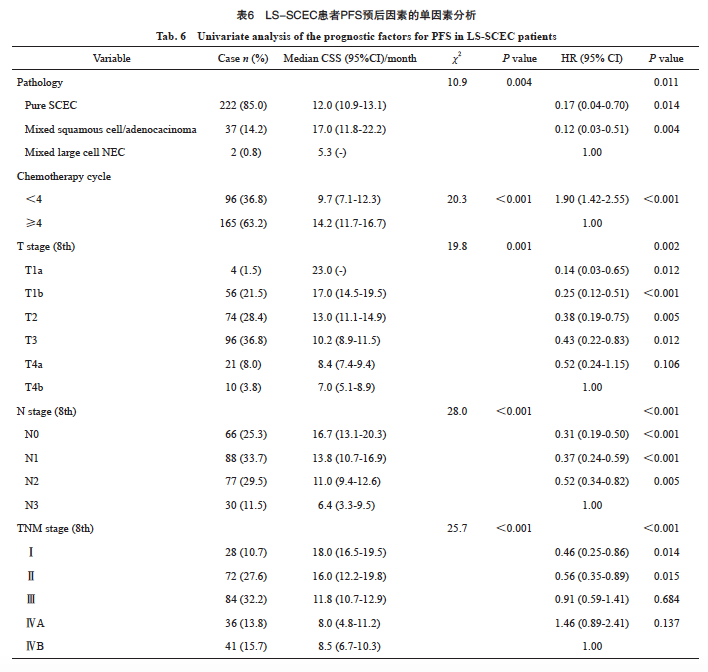
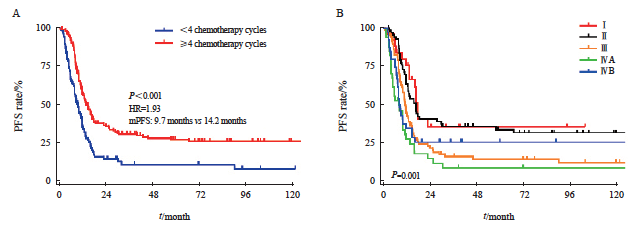
图4 LS-SCEC患者化疗周期和分期对PFS的影响
Fig. 4 Impact of chemotherapy cycles and stage on PFS in LS-SCEC patients
A: Chemotherapy cycle; B: Stage.
2.4.2 在倾向性评分匹配(propensity score matching,PSM)人群中分析LS-SCEC的治疗
本研究拟进一步分析根治性放化综合治疗、根治性手术+辅助化疗在LS-SCEC患者中治疗的差异,两组患者基线性别、年龄、体力状态评分和合并症数据均无明显差异,而放化综合治疗组颈段和上段患者更多,分期更晚,长度更长,接受4个周期化疗的患者数更多(表7)。本研究采用PSM的方法将上述不均衡变量进行匹配,成功匹配44对,上述4个基线不均衡特征在匹配后均衡可比。匹配后放化综合治疗组的中位CSS为60.2个月(95% CI:15.7~104.7),根治性手术+辅助化疗组的中位CSS为25.0个月(95% CI:9.3~40.7,P=0.179)。放化综合治疗组的中位PFS为16.7个月(95% CI:5.1~28.3),根治性手术+辅助化疗组的中位PFS为13.1个月(95% CI:10.7~15.5,P=0.582),生存曲线见图5。
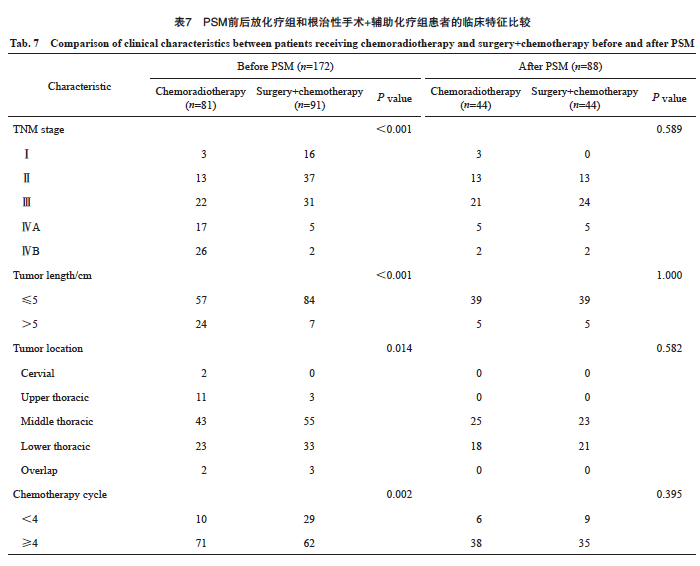
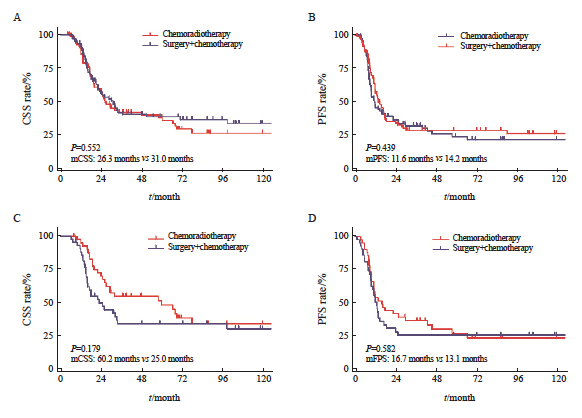
图5 LS-SCEC患者行手术+辅助化疗与放化疗PSM前后的CSS和PFS曲线
Fig. 5 CSS and PFS curves before and after PSM in LS-SCEC patients undergoing surgery+chemotherapy vs chemoradiotherapy
A: CSS curve before PSM; B: PFS curve before PSM; C: CSS curve after PSM; D: PFS curve after PSM.
3 讨 论
SCEC恶性程度高、患者预后极差,由于其罕见性,目前无特异性分期,短期内无法通过设计前瞻性随机对照临床试验来指导治疗,很多临床经验是借鉴于相对成熟的小细胞肺癌(small cell lung cancer,SCLC)的治疗体系,然而患者预后仍较差,疗效始终无法有所突破。本研究旨在回顾性分析LS-SCEC患者的生存状态、预后因素及失败模式,并对不同的治疗策略进行探讨。
SCEC具有高度异质性,迄今为止,其发病机制仍不明确,找到影响SCEC预后的主要因素,提高患者的生存率,是目前重要的研究方向。然而,由于其罕见性,目前发现的预后因素多为临床特征,生物标志物极少。此外,临床因素作为预后因素,既往研究亦无较为统一的结论,且SCEC患者PFS的预后因素更是鲜有报道。本研究在较大样本量的数据中发现,AJCC第8版食管癌TNM分期及化疗周期数是LS-SCEC患者CSS和PFS的独立预后因素。由于SCEC尚无特异的分期系统以评估预后,目前多参考VALSG SCLC分期标准和AJCC第8版食管癌TNM分期系统进行分期,但前者二分类的方法过于简单,对LS-SCEC患者而言,大量患者无法再进一步细分,分期提供的信息不全面。食管癌TNM分期并不特异性的针对SCEC,其在SCEC中的价值存在较大争议,既往研究[23-24]提示,食管癌的TNM分期并不能很好地反映SCEC患者的预后。本研究结果虽提示了TNM分期在LS-SCEC患者预后中的作用,但Ⅰ期与Ⅱ期间、Ⅲ期与Ⅳ期间患者的生存仍无法区分。总体而言,SCEC远处转移风险高,即使既往研究提示的预后因素多样化而难以统一,但较早的肿瘤分期、更充分的化疗预示着更好的生存结局。此外,SCEC特异性的临床分期系统仍需大量研究加以完善,以期更好地服务于临床。
由于大部分SCEC患者就诊时已存在微转移或远处转移,化疗被认为是SCEC治疗的基石[14-15,18,25-28],尤其适用于中晚期患者,推荐化疗周期数≥4[5,14,29-30]。对于LS-SCEC患者,化疗虽是主要的治疗方法,但其疗效有限。手术和放疗是LS-SCEC主要的局部治疗方法,局部治疗与系统化疗相结合的多学科治疗取得了良好效果,且明显优于单纯化疗,因此多学科综合治疗已成为LS-SCEC主要的治疗模式[5,17,31-32]。但先前发表的病例报告和回顾性研究并没有就局部治疗得出一致意见,最佳组合方式尚无定论。来自美国监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库的大型回顾性研究[33]分析了387例SCEC患者的生存及预后,发现手术治疗患者的总生存(overall survival,OS)优于非手术治疗患者。然而手术创伤较大,大多数患者的生存质量需要9.0~12.0个月才能恢复到术前水平[34],术后并发症可能会影响或耽误术后辅助治疗的进行。Meng等[14]比较了127例一线手术联合化疗与放疗联合化疗的LS-SCEC患者的生存情况,发现放化疗可使患者明显获益,尤其对于ⅡB期、Ⅲ期及区域淋巴结阳性的患者。亦有部分研究[11,15]提示在化疗的基础上联合手术或放疗的疗效相似。考虑到既往回顾性研究多为小规模队列研究或数据库研究,质量控制参差不齐,限制了其数据的临床应用,迫切需要更高级别的循证医学证据。中国SCEC协作组(ChiSCEC)近期发表的研究[5]结果提示,对于接受多学科治疗的非转移性/LS-SCEC,放疗与手术的疗效相当,与本研究结果一致。局部治疗的个性化决策应综合考虑肿瘤的位置、长度、合并症及患者保留器官的意愿。但该研究未提及上述治疗手段的次序、新辅助治疗及安全性等问题。此外,SCEC较差的预后并不能独立于疾病的临床分期之外,应考虑根据患者的临床分期提供多种模式的治疗方案,而非仅根据组织学类型。日本的多中心研究[35]发现,日本分期为Ⅲ~Ⅳ期的食管神经内分泌癌患者,接受放化疗患者的OS最优。而本研究结果显示,肿瘤位于颈段及胸上段、长度更长、分期更晚的患者更倾向于接受放化疗,且放化疗组接受≥4个周期化疗者比例更高,以手术为主的综合治疗与放化疗各自的最优人群仍有待未来进一步研究。综上所述,即使循证医学证据有限,目前可以较为肯定的是,考虑到食管癌根治术耐受性较差,放化综合治疗在改善LS-SCEC患者预后上具有一定优势,尤其对于体质差、合并内科疾病较多、拒绝手术的患者,放化综合治疗宜作为LS-SCEC的首选治疗模式。
新辅助治疗是食管癌综合治疗中重要的组成部分,新辅助化疗在肿瘤降期、提高手术完全切除率、减少远处转移和耐受性等方面较辅助化疗具有优势。关于LS-SCEC新辅助化疗的研究较少且争议颇大。Xu等[36]研究发现Ⅲ期SCEC患者新辅助化疗后手术的OS率明显优于单手术或不接受手术的患者,该团队最新的研究数据[16]显示,对于临床分期为cT3N0M0/T1-3N1M0的SCEC患者,接受新辅助治疗后再手术的患者的长期生存期优于手术加辅助治疗和仅接受手术的患者(5年生存率分别为27.2%、9.5%和0.0%,P=0.014)。Cai等[37]研究显示,术前接受新辅助化疗的SCEC患者pCR率为8.8%,与前置手术组相比,新辅助化疗+手术组患者有更好的OS(26.0个月 vs 19.5个月,P=0.011)和PFS (16.0个月 vs 13.0个月,P=0.039)。在日本的多中心研究[35]中,38.8%的手术患者接受了新辅助化疗,然而该组患者的OS却明显差于未接受新辅助化疗的患者。随着免疫时代的到来,免疫新辅助治疗改变了食管癌的临床实践,已成为目前食管癌治疗的热点。在本研究中,16例患者行新辅助治疗后手术,该组患者目前的PFS和CSS数据与手术+辅助治疗组和放化疗组无显著差异。其中8例在新辅助紫杉醇+铂类药物化疗的基础上联合PD-1单抗,该方案在病理学缓解率方面并未优于传统的以依托泊苷为主的方案。由于本研究中新辅助免疫治疗组患者数量较少且随访时间尚短,具体疗效有待进一步观察。
本研究存在一定的局限性。首先,这是一项回顾性研究,患者的选取局限于单中心,可能存在选择性偏倚。其次,PSM是为了减少组间的选择偏倚,但代表性和外推性问题不可忽视,对于相关结论仍需扩大样本、完善数据进一步验证。由于SCEC的罕见性,目前还有很多临床问题尚未解决,如SCEC内镜治疗指征、ⅠB期患者术后是否需行辅助化疗、LS-SCEC放疗合理靶区、剂量及免疫治疗价值、最佳化疗方案等。
本研究是一项针对LS-SCEC患者的较大样本、数据较全面细致且随访时间较长的回顾性分析,提示TNM分期及化疗周期数是SCEC患者CSS和PFS的独立预后因素。放化疗组与手术+辅助化疗组的CSS及PFS差异均无统计学意义。SCEC远处转移风险高且呈高度异质性,LS-SCEC患者的治疗应注重个体化,期待未来更大样本量、更高质量研究的进一步证实。
第一作者:
刘笛,博士,主治医师。
通信作者:
张军华,博士,副主任医师。
作者贡献声明:
刘笛:提出研究方向、数据整理与分析、论文写作;倪建佼:论文数据整理与分析;赵快乐,章真,相加庆:课题设计、论文指导;张军华:论文指导 与修改。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] ZHU Y, QIU B, LIU H, et al. Primary small cell carcinoma of the esophagus: review of 64 cases from a single institution[J]. Dis Esophagus, 2014, 27(2): 152-158.
[3] MCKEOWN F. Oat-cell carcinoma of the oesophagus[J]. J Pathol Bacteriol, 1952, 64(4): 889-891.
[4] YAMASHITA S, ABE H, YAMASHITA H, et al. PD-L1 and HLA-class Ⅰ expression status and their therapeutic implication in oesophageal small-cell carcinoma[J]. Histopathology, 2023, 83(2): 264-275.
[5] ZHU J, WANG Y, SUN H F, et al. Surgery versus radiotherapy for limited-stage small cell esophageal carcinoma: a multicenter, retrospective, cohort study in China (ChiSCEC)[J]. Int J Surg, 2024, 110(2): 956-964.
[6] HUNCHAREK M, MUSCAT J. Small cell carcinoma of the esophagus. The Massachusetts General Hospital experience, 1978 to 1993[J]. Chest, 1995, 107(1): 179-181.
[7] LIU S X, GE X L, GAO Z Z, et al. Clinicopathological analysis of 67 cases of esophageal neuroendocrine carcinoma and the effect of postoperative adjuvant therapy on prognosis[J]. Medicine (Baltimore), 2021, 100(43): e27302.
[8] HUANG Q, WU H Y, NIE L, et al. Primary high-grade neuroendocrine carcinoma of the esophagus: a clinicopathologic and immunohistochemical study of 42 rep cases[J]. Am J Surg Pathol, 2013, 37(4): 467-483.
[9] NAKAJIMA Y, ZENDA S, MINASHI K, et al. Non-surgical approach to small cell carcinoma of the esophagus: does this rare disease have the same tumor behavior as SCLC?[J]. Int J Clin Oncol, 2012, 17(6): 610-615.
[10] AL MANSOOR S, ZISKE C, SCHMIDT-WOLF I G H. Primary small cell carcinoma of the esophagus: patient data metaanalysis and review of the literature[J]. Ger Med Sci, 2013, 11: Doc12.
[11] CHEN W W, WANG F, CHEN S B, et al. Detailed analysis of prognostic factors in primary esophageal small cell carcinoma[J]. Ann Thorac Surg, 2014, 97(6): 1975-1981.
[12] SITU D R, LIN Y B, LONG H, et al. Surgical treatment for limited-stage primary small cell cancer of the esophagus[J]. Ann Thorac Surg, 2013, 95(3): 1057-1062.
[13] ALFAYEZ M. Primary small cell oesophageal carcinoma: a retrospective study of different treatment modalities[J]. World J Clin Oncol, 2020, 11(10): 836-843.
[14] MENG M B, ZAORSKY N G, JIANG C, et al. Radiotherapy and chemotherapy are associated with improved outcomes over surgery and chemotherapy in the management of limited-stage small cell esophageal carcinoma[J]. Radiother Oncol, 2013, 106(3): 317-322.
[15] LV J M, LIANG J, WANG J W, et al. Primary small cell carcinoma of the esophagus[J]. J Thorac Oncol, 2008, 3(12): 1460-1465.
[16] XU L, YANG Y S, LI B, et al. Multimodality therapy and survival outcomes in resectable primary small cell carcinoma of the esophagus: a multicenter retrospective study[J]. Ann Surg Oncol, 2025, 32(2): 848-859.
[17] VERMA V, SLEIGHTHOLM R L, FANG P, et al. National Cancer Database report of nonmetastatic esophageal small cell carcinoma[J]. Cancer Med, 2018, 7(12): 6365-6373.
[18] RAJA S, RICE T W, RAJESWARAN J, et al. Esophageal small-cell cancer: study of a rare disease[J]. Dis Esophagus, 2013, 26(7): 690-695.
[19] WANG H H, ZAORSKY N G, MENG M B, et al. Multimodality therapy is recommended for limited-stage combined small cell esophageal carcinoma[J]. Onco Targets Ther, 2015, 8: 437-444.
[20] YOO J E, HAN K, SHIN D W, et al. Association between changes in alcohol consumption and cancer risk[J]. JAMA Netw Open, 2022, 5(8): e2228544.
[21] 中华人民共和国国家卫生健康委员会医政医管局. 食管癌诊疗指南(2022年版)[J]. 中华消化外科杂志, 2022(10): 1247-1268.
Bureau of Medical Administration, National Health Commission of the People’s Republic of China. Standardization for diagnosis and treatment of esophageal cancer (2022 edition)[J]. Chin J Dig Surg, 2022(10): 1247-1268.
[22] NISHINO M, JACKMAN D M, HATABU H, et al. New Response Evaluation Criteria in Solid Tumors (RECIST) guidelines for advanced non-small cell lung cancer: comparison with original RECIST and impact on assessment of tumor response to targeted therapy[J]. AJR Am J Roentgenol, 2010, 195(3): W221-W228.
[23] WANG H H, CHEN Y B, PI G L, et al. Validation and proposed modification of the 8th edition American Joint Committee on Cancer staging system for patients with esophageal neuroendocrine neoplasms: evaluation of a revised lymph node classification[J]. Oncol Lett, 2020, 19(6): 4122-4132.
[24] 王肖飞, 张国庆, 吴 彬, 等. 食管神经内分泌癌患者原因别死亡竞争风险模型的建立与评价[J]. 临床肿瘤学杂志, 2019, 24(3): 231-236.
WANG X F, ZHANG G Q, WU B, et al. A competingrisks nomogram for cause-specific mortality in patients with esophageal neuroendocrine carcinoma[J]. Chin Clin Oncol, 2019, 24(3): 231-236.
[25] DING J, JI J, ZHU W, et al. A retrospective study of different treatments of limited-stage small-cell esophageal carcinoma and associated prognostic factor analysis[J]. Dis Esophagus, 2013, 26(7): 696-702.
[26] GAO R, ZHANG Y, WEN X P, et al. Chemotherapy with cisplatin or carboplatin in combination with etoposide for smallcell esophageal cancer: a systemic analysis of case series[J]. Dis Esophagus, 2014, 27(8): 764-769.
[27] ZHANG Y L, REN H Z, WANG L, et al. Clinical impact of tumor-infiltrating inflammatory cells in primary small cell esophageal carcinoma[J]. Int J Mol Sci, 2014, 15(6): 9718-9734.
[28] CHEN W W, WANG F, ZHANG D S, et al. Primary small cell carcinoma of the esophagus: clinicopathological study of 44 cases[J]. BMC Cancer, 2014, 14: 222.
[29] LI J Y, MA J, WANG H, et al. Population-based analysis of small cell carcinoma of the esophagus using the SEER database[J]. J Thorac Dis, 2020, 12(7): 3529-3538.
[30] JEENE P M, GEIJSEN E D, MUIJS C T, et al. Small cell carcinoma of the esophagus: a nationwide analysis of treatment and outcome at patient level in locoregional disease[J]. Am J Clin Oncol, 2019, 42(6): 534-538.
[31] HOU X, WEI J C, WU J X, et al. Multidisciplinary modalities achieve encouraging long-term survival in resectable limiteddisease esophageal small cell carcinoma[J]. PLoS One, 2013, 8(7): e69259.
[32] WONG A T, SHAO M, RINEER J, et al. Treatment and survival outcomes of small cell carcinoma of the esophagus: an analysis of the National Cancer Data Base[J]. Dis Esophagus, 2017, 30(2): 1-5.
[33] JATOI A, MILLER R C. Should we recommend surgery to patients with limited small cell carcinoma of the esophagus?[J]. J Thorac Oncol, 2008, 3(12): 1373-1376.
[34] KUKAR M, GROMAN A, MALHOTRA U, et al. Small cell carcinoma of the esophagus: a SEER database analysis[J]. Ann Surg Oncol, 2013, 20(13): 4239-4244.
[35] SOHDA M, KUWANO H, SAEKI H, et al. Nationwide survey of neuroendocrine carcinoma of the esophagus: a multicenter study conducted among institutions accredited by the Japan Esophageal Society[J]. J Gastroenterol, 2021, 56(4): 350-359.
[36] XU L, LI Y, LIU X B, et al. Treatment strategies and prognostic factors of limited-stage primary small cell carcinoma of the esophagus[J]. J Thorac Oncol, 2017, 12(12): 1834-1844.
[37] CAI G K, WANG J, ZOU B W, et al. Preoperative chemotherapy for limited-stage small cell carcinoma of the esophagus[J]. Ann Thorac Surg, 2022, 114(4): 1220-1228.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#局限期# #食管小细胞癌#
6 举报