Cell Res:EGFR活化mTORC1促进肿瘤增殖
2025-05-14 MedSci原创 MedSci原创 发表于上海
本研究揭示了EGFR在溶酶体上通过非依赖激酶活性的方式直接激活mTORC1的新机制。不仅增进了我们对EGFR在细胞生长和癌症发生中作用的理解,还为开发针对EGFR突变癌症的新疗法提供了重要的理论依据。
表皮生长因子受体(EGFR)是一种具有酪氨酸激酶活性的受体,其在细胞增殖、分化和生存中起着关键作用。EGFR的异常激活,尤其是由于基因突变导致的持续性激活,与多种癌症的发生发展密切相关,其中包括非小细胞肺癌(NSCLC)。传统的观点认为,EGFR主要通过其酪氨酸激酶活性,激活下游的PI3K/AKT信号通路,进而促进细胞生长和增殖。然而,近年来的研究表明,EGFR还具有不依赖于其激酶活性的生物学功能,这些功能在细胞存活和癌症进展中可能同样重要。
mTORC1(雷帕霉素复合物1)是细胞生长和代谢的核心调控因子,它通过调节蛋白质、脂质和核酸的合成以及自噬过程来响应细胞内外的信号。mTORC1的激活依赖于两种小G蛋白Rag和Rheb,它们位于溶酶体表面。Rag GTP酶负责将mTORC1从细胞质转运到溶酶体,而Rheb则在溶酶体表面直接激活mTORC1。尽管EGFR作为Rheb的上游信号分子之一,其激活mTORC1的具体机制尚不完全清楚。
近日,国际权威期刊Cell Research上在线发表了题为“Lysosomal EGFR acts as a Rheb-GEF independent of its kinase activity to activate mTORC1”的最新研究成果,该研究揭示了EGFR在溶酶体上通过非依赖激酶活性的方式直接激活mTORC1的新机制。

研究人员首先分析了EGFR-TKIs对mTORC1激活的不同影响。通过检测NSCLC患者样本中p-T389-S6K1(mTORC1活性的标志)的水平,发现接受afatinib治疗的患者样本中mTORC1的抑制程度显著高于接受erlotinib治疗的患者。在细胞模型中,afatinib处理的PC9和HCC827细胞(均携带EGFR突变)显示出比erlotinib处理更低的mTORC1激活水平。这表明EGFR的激酶活性可能不是mTORC1激活的必要条件。
研究发现,EGFR的溶酶体定位对于mTORC1的激活至关重要。通过抑制EGFR从早期内体向溶酶体的转运,研究人员观察到mTORC1激活显著降低,而EGFR的激酶活性和下游AKT信号不受影响。这表明EGFR的溶酶体定位可能是其激活mTORC1的关键步骤。
研究人员进一步探讨了EGFR如何激活mTORC1。他们发现,在携带EGFR突变的细胞系中,EGFR与Rheb在溶酶体表面共定位。通过结构分析和免疫共沉淀实验,证实了EGFR的TKD能够直接与Rheb相互作用,并且这种相互作用不依赖于EGFR的激酶活性。此外,afatinib能够破坏EGFR与Rheb的相互作用,而erlotinib则不能。
考虑到Rheb的核苷酸结合状态对其激活mTORC1的关键作用,研究人员假设EGFR可能通过影响Rheb的GTP结合状态来调节其活性。实验结果表明,afatinib处理的细胞中Rheb-GTP水平显著降低,而erlotinib处理则无此效果。进一步的实验显示,EGFR的TKD能够优先与GDP结合或无核苷酸的Rheb相互作用,并在体外促进Rheb的核苷酸交换。这些结果表明EGFR可能作为Rheb的GEF,促进Rheb从GDP结合状态转变为GTP结合状态。
研究人员利用AlphaFold2模型预测了EGFR-TKD和Rheb的复合物结构,发现EGFR的Glu804可能与Rheb的核苷酸结合口袋相互作用,类似于Arf1-GEF cytohesin-2通过谷氨酸手指促进Arf1的核苷酸交换的机制。通过突变分析,研究人员发现将EGFR的E804突变为赖氨酸(E804K)会显著削弱EGFR与Rheb的相互作用,并消除EGFR对Rheb的核苷酸交换活性。
研究人员构建了EGFR-E804K基因敲入的PC9和HEK-293T细胞模型,发现E804K突变显著抑制了mTORC1的激活,同时降低了Rheb的GTP结合水平。此外,E804K突变细胞的增殖能力也显著下降,对afatinib的敏感性降低,而在体内实验中,E804K突变的小鼠肿瘤生长和重量也显著减少。
为了克服现有EGFR-TKIs的局限性,研究人员设计了一种新型小分子化合物BIEGi-1,该化合物能够同时抑制EGFR的激酶活性和Rheb-GEF活性。实验结果显示,BIEGi-1在体外对EGFR突变细胞的增殖具有强效抑制作用,并且能够有效破坏EGFR与Rheb的相互作用,抑制mTORC1的激活。在动物模型中,BIEGi-1也显示出良好的抗肿瘤效果。
综上所述,本研究揭示了EGFR在溶酶体上通过非依赖激酶活性的方式直接激活mTORC1的新机制。研究结果表明,EGFR的TKD能够作为Rheb的GEF,通过其E804位点促进Rheb的核苷酸交换,从而激活mTORC1。这一发现不仅增进了我们对EGFR在细胞生长和癌症发生中作用的理解,还为开发针对EGFR突变癌症的新疗法提供了重要的理论依据。研究人员开发的新型双重EGFR抑制剂BIEGi-1,通过同时靶向EGFR的激酶活性和Rheb-GEF活性,显示出对EGFR突变癌细胞的强大抑制作用,为未来临床应用提供了有前景的候选药物。
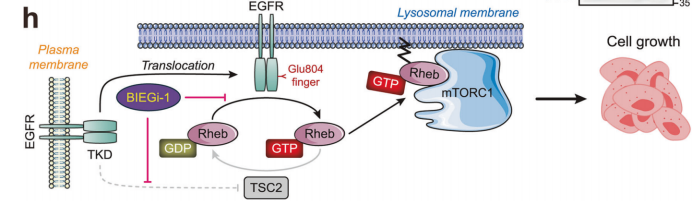
图 本研究模式图
原始出处:
Lysosomal EGFR acts as a Rheb-GEF independent of its kinase activity to activate mTORC1. Cell Res. 2025 Apr 21. doi: 10.1038/s41422-025-01110-x. Epub ahead of print. PMID: 40259053.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#mTORC1# #表皮生长因子受体#
27 举报
溶酶体激活的新机制
20 举报