四川大学何勤教授/李曼副教授最新研究AM:通过构建人工受体靶向阻断外泌体通讯抑制胰腺癌肝转移
2023-08-04 BioMed科技 BioMed科技 发表于上海
四川大学华西药学院何勤教授&李曼副教授团队利用细胞糖代谢工程原理和生物正交点击化学反应,设计了一种序贯给药策略,通过构建“人工受体”实现了原位肿瘤和肿瘤外泌体的双重靶向。
外泌体是大多数细胞都可分泌的一种纳米级细胞外囊泡(EVs),其携带多种功能分子,如蛋白质、糖类、脂质、代谢物、RNA和DNA等,在细胞间通讯中发挥重要作用。在肿瘤转移过程中,原发肿瘤细胞分泌的外泌体可迁移到远端器官进行细胞间交流,诱导远端器官形成转移前小生境(PMN),以支持肿瘤的定植和增殖。靶向干扰肿瘤外泌体的生物过程有望抑制肿瘤转移。
然而,同时实现肿瘤外泌体和原发肿瘤的靶向尚存在挑战。为了克服这一难题,四川大学华西药学院何勤教授&李曼副教授团队利用细胞糖代谢工程原理和生物正交点击化学反应,设计了一种序贯给药策略,通过构建“人工受体”实现了原位肿瘤和肿瘤外泌体的双重靶向(图1)。首先,包载四乙酰化N-叠氮乙酰-d-甘露聚糖(Ac4ManNAz)的纳米粒(命名为Ac4ManNAz-DP)可响应原发肿瘤中肿瘤细胞的代谢活动,通过参与肿瘤细胞内唾液酸的合成而在肿瘤细胞膜表面引入“人工受体”——叠氮基团(N3),与此同时,其分泌的外泌体表面也被标记上N3;随后给予的二苯并环辛炔(DBCO)修饰的载药纳米粒(命名为DBCO-GEM/ISO-DP)即可通过生物正交点击化学反应,与肿瘤细胞及其外泌体发生特异性结合。研究结果表明,在胰腺癌自发转移模型中,该序贯式给药纳米系统不仅能抑制原位肿瘤的生长,还能通过追踪下调胰腺癌外泌体的巨噬细胞迁移抑制因子(MIF),阻断外泌体在诱导肝脏 PMN形成和肝转移中的通讯作用,从而抑制胰腺肿瘤的肝转移。该研究有望为以外泌体为靶点的抗肿瘤及其转移疗法提供新的策略和思路。
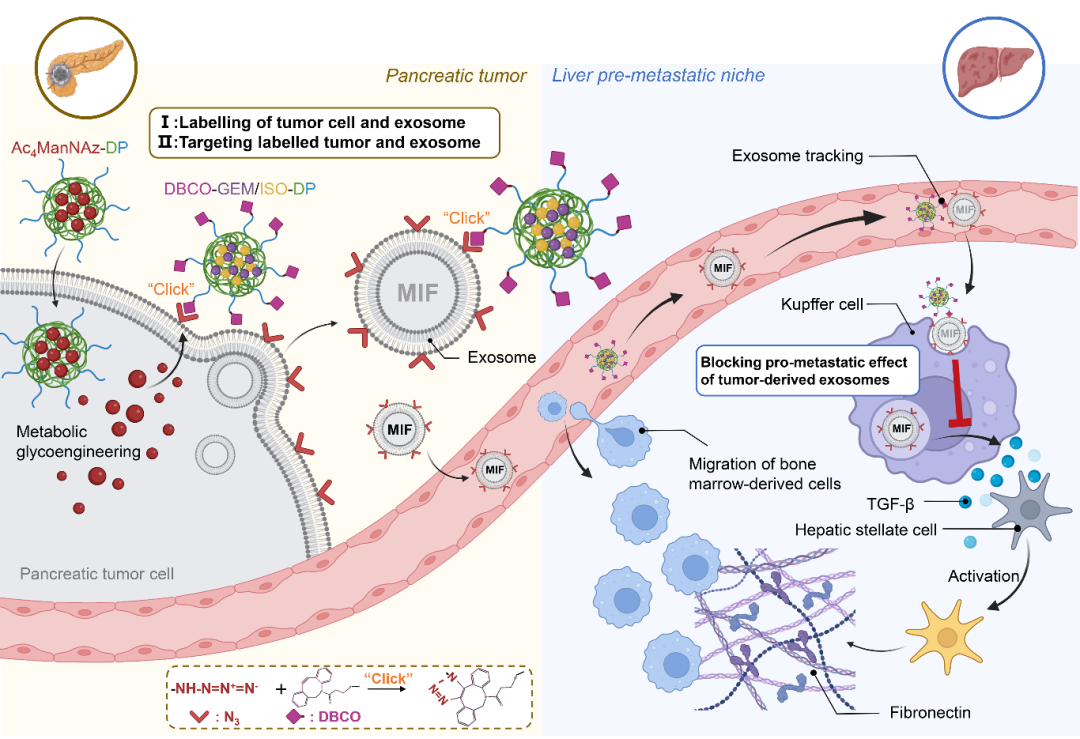
图1.基于糖代谢工程和生物正交点击化学的两步给药纳米系统,通过引入“人工受体”实现胰腺肿瘤及其外泌体的双重靶向,阻断外泌体通讯并抑制肝转移前小生境形成的示意图
相关研究成果近期发表在国际权威期刊《Advanced Materials》上,题为“Curb Exosome Communications via Introducing Artificial Membrane Receptors for Metastatic Pancreatic Cancer Therapy”。

邓淼博士为该文章的第一作者,何勤教授和李曼副教授为文章的通讯作者。郭蓉、王蛘也在该论文中作出了重要贡献。该研究得到了国家自然科学基金面上项目(82173761)、国家自然科学基金委员会与瑞典科研与教育国际合作基金会合作交流项目(NSFC-STINT 82311530116)以及四川省科技项目(2022NSFSC0045)的大力支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202303736
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







