CDD:不是铁死亡!武汉大学孙志军等团队合作发现癌细胞逃避铜死亡的新机制
2024-08-12 iNature iNature 发表于上海
该研究发现铜死亡激活了Wnt/β-catenin通路。
铜死亡的特点是三羧酸循环的脂酰化酶聚集,随后铁硫簇蛋白的损失,这是一种独特的依赖铜的受调节细胞死亡形式。由于铜稳态失调可诱发铜死亡,因此利用铜死亡治疗癌症的兴趣日益浓厚。然而,癌细胞逃避铜死亡的分子驱动因素此前尚未明确。
2024年7月10日,武汉大学孙志军及华中科技大学胡传宇共同通讯在Cell Death & Differentiation 在线发表题为”Dysregulated Wnt/β-catenin signaling confers resistance to cuproptosis in cancer cells“的研究论文,该研究发现铜死亡激活了Wnt/β-catenin通路。从机制上讲,铜结合PDK1并促进其与AKT的相互作用,从而激活Wnt/β-catenin通路和癌症干细胞(CSC)特性。
值得注意的是,Wnt/β-catenin信号的异常激活赋予了CSCs对铜死亡的抗性。进一步研究表明,β-catenin/TCF4转录复合物直接结合ATP7B启动子,诱导其表达。ATP7B外排铜离子,减少细胞内铜,抑制铜死亡。TCF4的敲除或Wnt/β-catenin的药理学阻断增加了CSCs对elesclomol-Cu诱导的铜死亡的敏感性。这些发现揭示了由Wnt/β-catenin通路调控的铜稳态与铜死亡敏感性之间的联系,并提出了通过选择性铜死亡诱导癌症治疗的精准医学策略。

铜是细胞进行关键生物过程所必需的微量营养素。然而,细胞内过量的铜也可能是剧毒的。癌细胞倾向于积累异常高的铜水平,以满足其增加的营养需求。因此,这些细胞必须精确调节铜稳态,以确保足够的铜供应,同时避免毒性。人类细胞已经进化出复杂的机制来维持全身和细胞内的铜平衡。饮食中的铜通过SLC31A1转运体在肠道内被吸收,并受肝脏调节。细胞铜摄取也涉及SLC31A1和金属还原酶,后者产生Cu(I)状态。ATP7A/B转运体根据需要介导细胞铜外排。细胞质伴侣和谷胱甘肽(GSH)结合铜以防止游离毒性。在癌细胞中,铜需求的增加会压倒正常的缓冲,导致过量积累,尤其是在线粒体中。这种线粒体铜超载被发现会引发一种被称为铜死亡(cuprotosis)的受调节细胞死亡形式。
铜死亡不同于其他死亡方式,如细胞凋亡或铁死亡。铜死亡是由线粒体蛋白毒性应激而不是氧化应激介导的。具体来说,铜离子破坏了三羧酸(TCA)循环酶(如DLAT)的脂酰化,导致它们的低聚化。铁氧还蛋白FDX1在上游调控脂酰化途径。铜也通过FDX1结合并破坏铁硫簇蛋白的稳定性。脂酰化蛋白和铁硫蛋白的联合失调导致严重的代谢中断和蛋白质毒性应激,最终导致铜死亡。
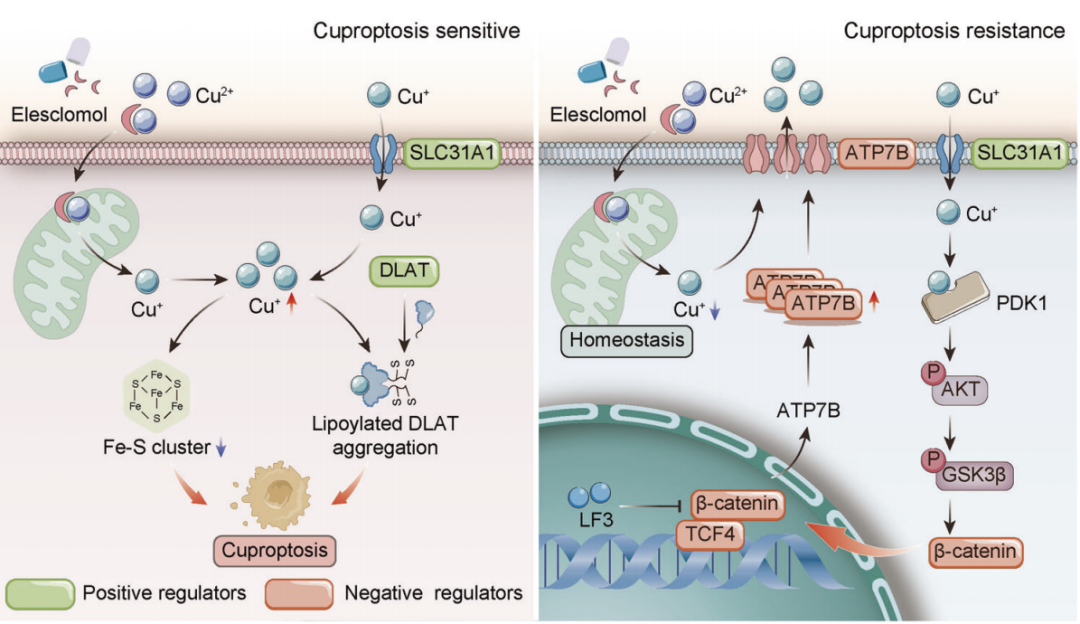
文章模式图(图源自Cell Death & Differentiation )
揭示这种进化上保守的细胞死亡机制,有助于深入了解严格的铜稳态机制进化的原因。它还揭示了一些表现出铜死亡的癌细胞的潜在脆弱性。最近,一项针对头颈部鳞状细胞癌(HNSCC)的研究系统地评估了铜死亡相关基因(CRG)的差异表达和遗传修饰,设计了CRG风险模型来预测患者预后。这项研究丰富了我们对靶向CRG的潜在药物治疗的认识。此外,elesclomol与铜死亡之间的关联也使人们对elesclomol作为铜离子载体的临床抗癌潜力重新产生了兴趣。
Wnt/β-catenin信号的异常激活在许多癌症中很常见,并促进肿瘤的生长和进展。同时,Wnt信号传导增强了癌细胞的干细胞样特性,使其能够自我更新,抵抗细胞毒性和靶向治疗。然而,铜死亡与癌症表型之间的联系以及Wnt/β-catenin通路调节铜死亡的确切机制仍然难以捉摸。进一步的研究可以促进铜死亡靶向治疗方法的改进。
该研究发现铜死亡过程伴随着Wnt/β-catenin通路的强大激活。从机制上讲,铜可以促进PDK1/AKT/GSK3β/β-catenin通路的激活和癌症干细胞(CSC)的特性。β-catenin/TCF4复合物调节细胞内铜稳态,并通过转录激活ATP7B赋予铜死亡抗性。此外,在体外和体内,敲除TCF4或药理抑制Wnt/β-catenin通路可增加癌细胞对铜死亡的敏感性。总之,该研究阐明了癌细胞逃避铜死亡的机制,并为诱导铜死亡用于癌症治疗提供了新的见解。
参考消息:
https://www.nature.com/articles/s41418-024-01341-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#铜死亡# #癌细胞逃避#
81