北京大学肿瘤医院,最新Nature Medicine,双特异性抗体-药物偶联物!
2025-07-12 BioMed科技 BioMed科技 发表于上海
近期,北京大学肿瘤医院沈琳教授,鲁智豪教授和龚继芳教授团队合作,报告了BL-B01D1在既往接受多线治疗的转移性ESCC患者中的1b期研究结果,明确了其推荐二期剂量并初步验证了其安全性和有效性。
食管鳞状细胞癌(ESCC)是全球发病率最高的食管癌类型,也是第七大癌症死亡原因。对于晚期ESCC患者,一线标准治疗通常是基于免疫检查点抑制剂(ICIs)联合铂类化疗的方案,但大多数患者最终出现耐药,长期生存率仍低于20%。在这种背景下,开发新的靶向治疗药物显得尤为迫切。
BL-B01D1是一种靶向EGFR和HER3的双特异性抗体-药物偶联物(ADC),通过可切割连接子与拓扑异构酶I抑制剂(Ed-04)偶联,能够同时封闭EGFR和HER3的信号传导,并实现药物的精准释放以诱导肿瘤细胞死亡。
近期,北京大学肿瘤医院沈琳教授,鲁智豪教授和龚继芳教授团队合作,报告了BL-B01D1在既往接受多线治疗的转移性ESCC患者中的1b期研究结果,明确了其推荐二期剂量(RP2D)并初步验证了其安全性和有效性。
2025年7月10日,相关研究成果在《Nature Medicine》期刊发表,题为“A bispecific antibody–drug conjugate targeting EGFR and HER3 in metastatic esophageal squamous cell carcinoma: a phase 1b trial”。论文共同第一作者是北京大学肿瘤医院刘畅博士、刘丹博士、新乡医学院第一附属医院姬颖华教授。

【主要内容】
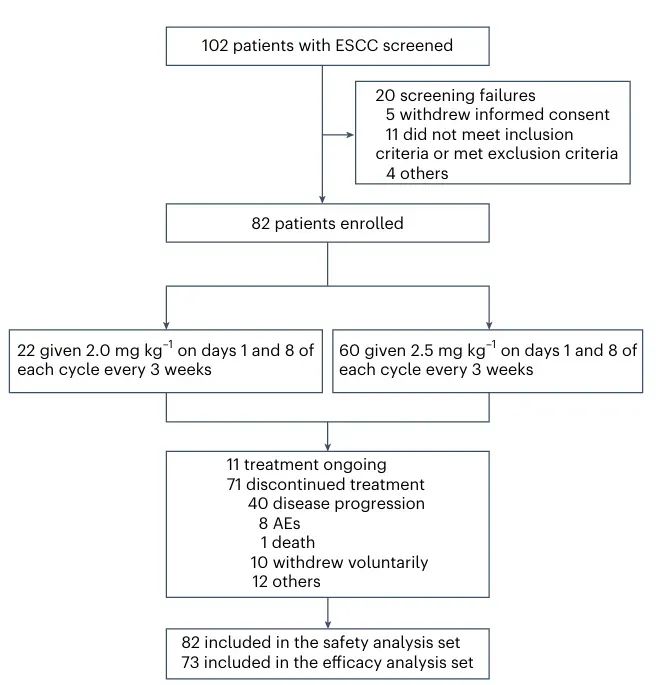
图1:CONSORT流程图
研究共筛选了102名转移性ESCC患者,其中20名因不符合纳入标准或撤回知情同意等原因未能入组,最终82名患者被纳入治疗阶段,分配到两个不同剂量组:22人接受2.0 mg/kg D1D8 Q3W方案,60人接受2.5 mg/kg D1D8 Q3W方案。随着研究的推进,截至数据截止日(2024年9月30日),共有71名患者停止治疗,主要由于疾病进展(40例),另有因治疗相关不良事件(8例)、自愿退出(10例)及其他原因(12例)停止治疗,仍有11名患者在继续接受BL-B01D1。该图清晰地勾勒出研究人群的流动过程,突出了研究样本来源的严谨性和完整性。
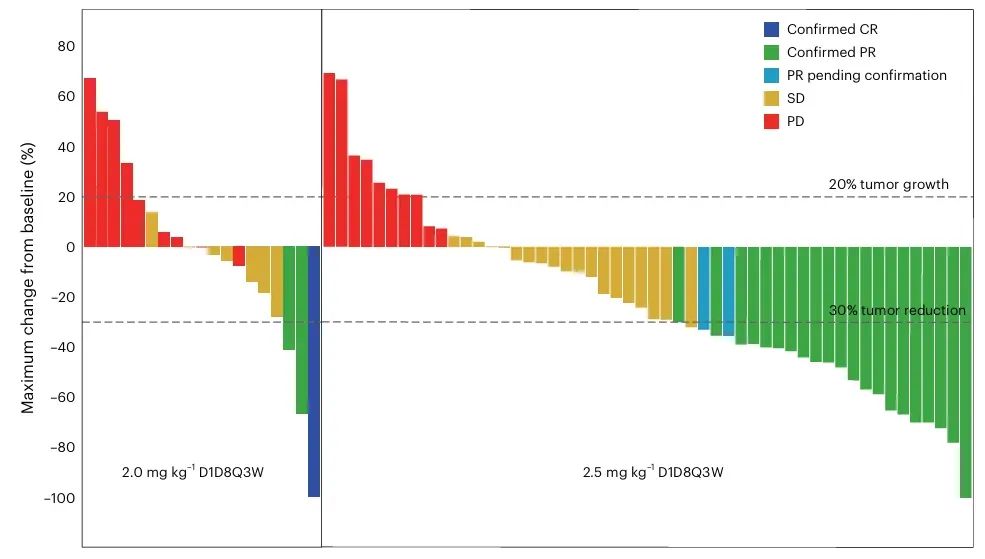
图2:抗肿瘤活性及缓解持续时间(DOR)
在2.0 mg/kg组中,大多数患者的肿瘤体积变化较小,只有少数患者达到明显缩小(−30%以下),表现出较低的确认客观缓解率(cORR 15.0%)和疾病控制率(DCR 50.0%)。相较之下,2.5 mg/kg组中瀑布柱下降明显的患者数量显著增多,确认客观缓解率达到39.6%,疾病控制率高达79.2%。这一结果表明,较高剂量BL-B01D1在肿瘤负荷减少方面具有更强的治疗潜力,直接支持了该剂量成为RP2D的依据。
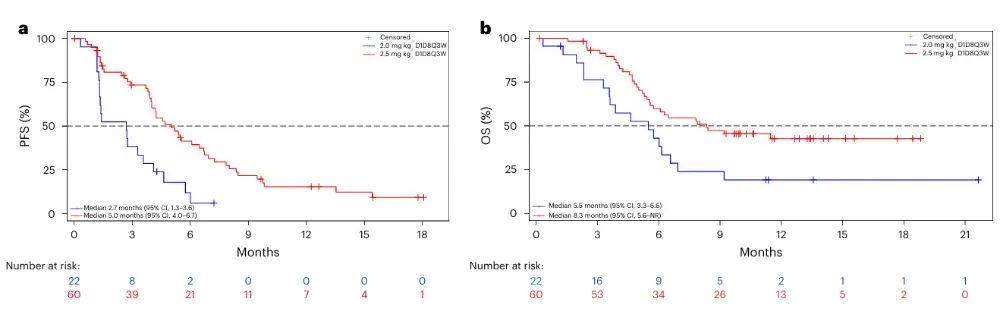
图3:无进展生存期(PFS)和总生存期(OS)的Kaplan–Meier估计曲线
通过Kaplan–Meier生存曲线比较两组患者的无进展生存期(PFS)与总生存期(OS)。在图3a中,2.5 mg/kg组的中位PFS为5.0个月(95% CI, 4.0–6.7),显著优于2.0 mg/kg组的2.7个月(95% CI, 1.3–3.6);图3b显示2.5 mg/kg组的中位OS为8.3个月(95% CI, 5.6–NR),也优于2.0 mg/kg组的5.5个月(95% CI, 3.3–6.6)。在较高剂量下患者疾病进展被有效延后,生存获益更为明显。
【全文总结】
综上所述,这项1b期研究首次在转移性、既往多线治疗失败的ESCC患者中系统评估了BL-B01D1的安全性和疗效。结果显示,BL-B01D1在2.5 mg/kg D1D8 Q3W剂量下展现出更优的客观缓解率、疾病控制率和生存期,同时具有可管理的安全性,为后续3期临床试验奠定了坚实基础,也为免疫耐药后的晚期ESCC患者提供了新的治疗希望。这一研究为精准靶向EGFR与HER3的双特异性ADC在消化道肿瘤治疗领域开辟了新的方向。
原文链接:
https://doi.org/10.1038/s41591-025-03792-7

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#食管鳞状细胞癌# #BL-B01D1#
10 举报