Adv Sci 空军军医大学西京医院孙冬冬团队通过单细胞测序技术揭示糖尿病心脏微血管损伤的关键病理过程和防治靶点
2024-11-01 论道心血管 论道心血管 发表于上海
该研究通过单细胞测序揭示了糖尿病心脏微血管损伤的关键病理过程和防治靶点,随后通过相关实验证实了Ets1对糖尿病小鼠心脏微血管损伤的防治作用。
糖尿病是当前社会重大的公共卫生问题,糖尿病相关代谢紊乱导致微血管功能异常,进而造成微血管损伤的多系统疾病。心脏微血管损伤是糖尿病患者的主要并发症,同时也是造成该人群死亡的首要原因。内皮功能障碍是糖尿病心脏微血管损伤的主要特征,但其病理机制仍不明确。
2024年10月30日,空军军医大学孙冬冬教授团队在Advanced Science杂志发表题为“Single-Cell RNA Sequencing Uncovers Pathological Processes and Crucial Targets for Vascular Endothelial Injury in Diabetic Hearts”的文章。该研究以瘦素受体敲除小鼠(db/db)为糖尿病模型,对不同病理阶段的小鼠心脏进行单细胞测序。随后通过细胞亚群聚类、差异基因分析、细胞间通讯分析、拟时序分析、转录因子分析等方法揭示了糖尿病心脏微血管损伤的潜在机制。

经过质量控制和数据过滤,该研究从八组不同糖尿病阶段的小鼠心脏中共得到63825个细胞,这些细胞被聚类为37个亚群,包含成纤维细胞、内皮细胞、以及少量心肌细胞和免疫细胞,其中内皮细胞共有11个亚群。
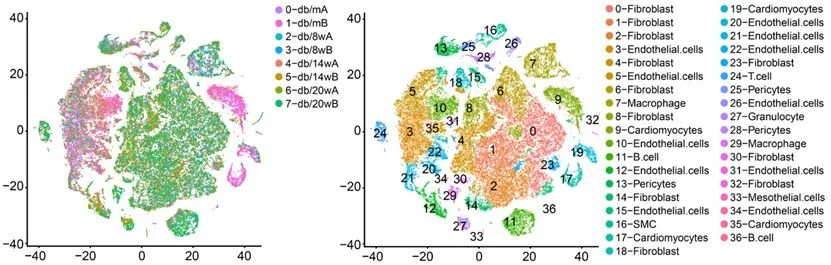
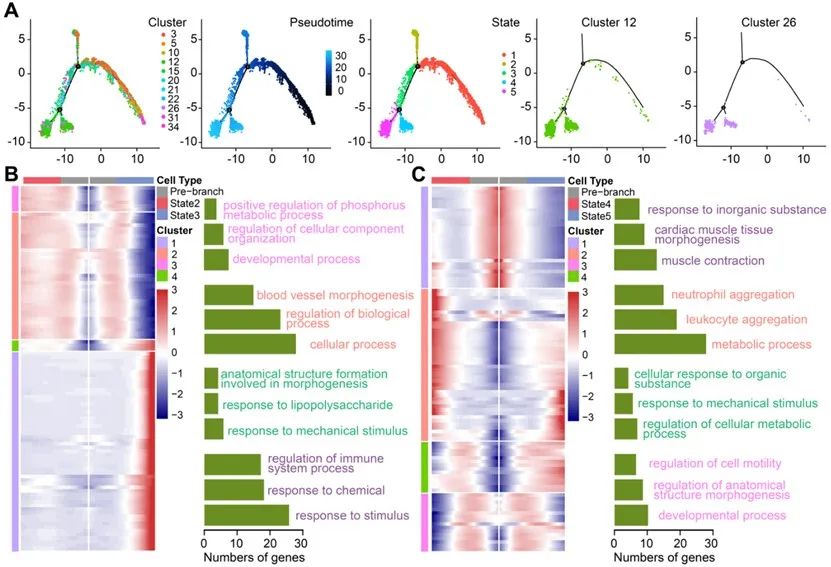
结合细胞亚群动态分析、命运分析和功能分析,内皮细胞以3、5、10亚群为代表的细胞亚群主要负责维护血管正常的生理功能,包括血管内径调节、一氧化氮代谢等,其细胞比例随糖尿病进展逐步降低。以12和26为代表的细胞亚群与血管炎症密切相关,其细胞比例随糖尿病进展逐步升高。这两类细胞亚群不同的比例变化共同促进了糖尿病心脏微血管损伤。
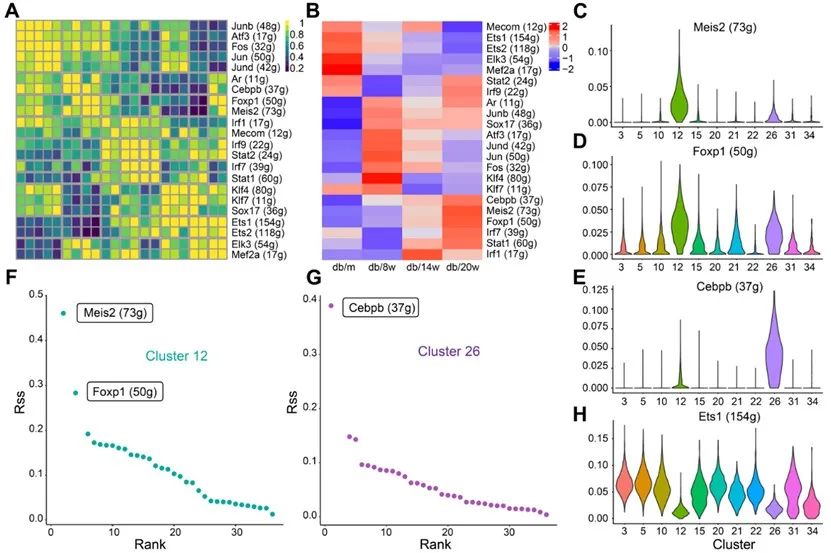
通过SCENIC分析方法筛选出内皮细胞转录活性较高的22个转录因子调控网络。其中参与调控靶基因最多的是Ets1,组间变化提示Ets1调控网络的活性随糖尿病进展降低。除此之外,Meis2、Foxp1和Cebpb等调控网络的活性随糖尿病进展升高,而这些转录因子主要在12和26亚群中表达。
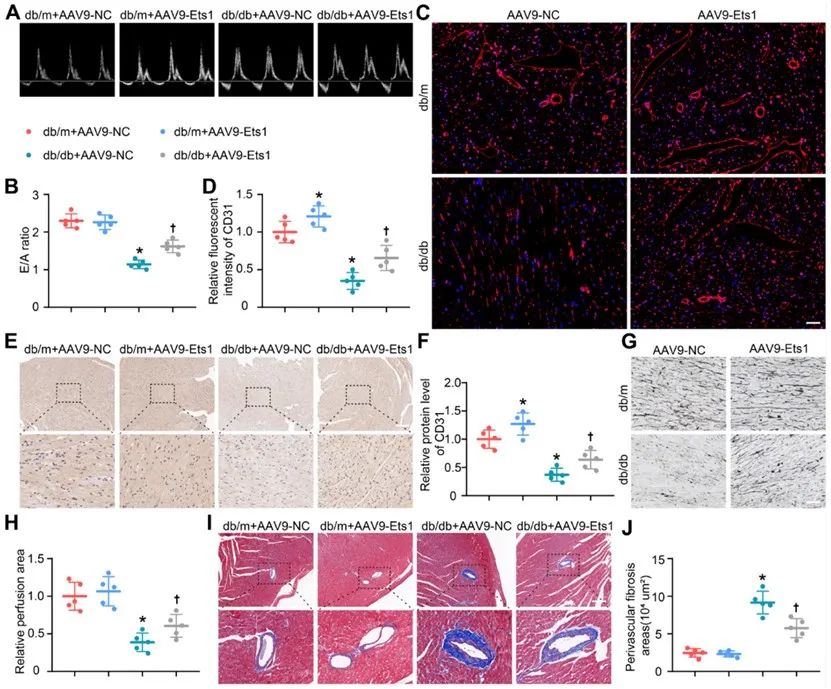
研究表明Ets1在血管发育中发挥重要作用,小鼠内皮细胞Ets1的缺失会降低多种血管生成相关基因的表达,进而造成冠状动脉发育受损。除此之外,Ets1还被证实具有抵抗血管炎症和纤维化的作用。因此研究人员采用内皮特异性腺相关病毒在体干预小鼠Ets1表达水平,评估了Ets1在糖尿病心脏微血管损伤中的作用。最终通过多种实验证实了Ets1对糖尿病小鼠心脏功能、心脏血管密度、管周纤维化以及生存率的改善,发现Ets1有望成为糖尿病心脏微血管损伤新的干预靶点。
综上,该研究通过单细胞测序揭示了糖尿病心脏微血管损伤的关键病理过程和防治靶点,随后通过相关实验证实了Ets1对糖尿病小鼠心脏微血管损伤的防治作用。
该研究获得国家自然科学基金(82070398和81922008)等项目资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202405543
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#单细胞测序# #糖尿病心脏微血管损伤#
54