EGFR L861Q阳性肺腺鳞癌接受阿美替尼治疗后转化为大细胞神经内分泌癌,检出EGFR/RB1/TP53突变获益化疗
2025-04-12 苏州绘真医学 苏州绘真医学 发表于重庆
本病例强调,对于接受阿美替尼治疗的非小细胞肺癌患者,在出现耐药时及时进行病理组织活检具有重要临床意义。
阿美替尼是一种第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),对表皮生长因子受体酪氨酸激酶抑制剂敏感突变及T790M耐药突变均具有选择性抑制作用。然而第三代EGFR-TKIs的耐药性仍不可避免。已有报道指出,阿美替尼治疗期间可出现继发性EGFR突变和旁路信号通路激活。本文报告一例罕见的EGFR L861Q阳性肺腺鳞癌病例,该患者在阿美替尼治疗后转化为大细胞神经内分泌癌。患者在开始阿美替尼治疗 8 个月后出现疾病进展,血液基因检测显示EGFR L861Q和EGFR L858R突变。疾病进展后的肺组织活检确诊为大细胞神经内分泌癌,后续采用顺铂联合依托泊苷治疗显示疗效。向神经内分泌癌的组织学转化是肺腺鳞癌对阿美替尼产生耐药性的机制之一。即使发生神经内分泌癌转化,EGFR突变仍可能持续存在。本病例强调,对于接受阿美替尼治疗的非小细胞肺癌患者,在出现耐药时及时进行病理组织活检具有重要临床意义。
背 景
肺腺鳞癌(ASC)是非小细胞肺癌(NSCLC)中相对罕见的亚型,仅占所有肺癌的 2%–3%。研究表明,ASC更多见于男性患者,吸烟史已被证实是ASC发生的高危因素。已知的ASC相关突变包括EGFR、ERBB2、KRAS、BRAF、PIK3CA、RET、ALK等基因突变。本文报告一例罕见的EGFR阳性肺腺鳞癌病例,该患者在阿美替尼治疗后出现疾病进展,重复活检证实其耐药机制为向大细胞神经内分泌癌(LCNEC)的组织学转化。针对这一发现实施化疗治疗,最终成功实现了患者的疾病控制。
病 例
患者男,43 岁,汉族,无吸烟史。图1展示了该病例的临床病程时间轴。2021 年 11 月,患者因咳嗽、咯血及胸闷症状就诊。CT检查显示右肺上叶占位,伴纵隔右肺门及右侧胸膜转移。2021 年 12 月行肺占位及胸膜活检,病理确诊为腺鳞癌。免疫组化显示癌巢状排列伴局灶实性区域,CK(+)、CK7(+)、CK5/6(+)、P63(+)、P40(+)、TTF-1弱阳性,S100(-)(图2A)。临床分期cT4N1M1a IVa期。组织基因检测显示EGFR L861Q突变(变异丰度 70.50%)及PTEN突变(变异丰度 67.20%)。患者随即开始每日口服一次 110 mg阿美替尼治疗,定期随访评估为疾病稳定(SD)。2022 年 8 月随访CT提示右侧胸膜转移灶进展并出现心包积液,疗效评估为疾病进展(PD)。因患者拒绝重复组织活检,行血液基因检测,结果显示EGFR L861Q(变异丰度 11.00%)、EGFR L858M(变异丰度11.94%),以及RB1(9.20%)、TP53(12.97%)、PTEN(12.51%)、SMARCA4(0.96%)等突变。患者接受"培美曲塞+顺铂+贝伐珠单抗+信迪利单抗"方案治疗 3 个周期。2022 年 12 月CT显示右主支气管闭塞、右肺不张,伴右肺门及纵隔淋巴结转移,右侧胸膜及心包浸润加重,右侧胸腔及心包积液量增加。2023 年 2 月CT提示胸/心包积液进一步增多,并出现肝、脑、骨转移。2022 年 8 月至 2023 年 2 月期间,患者胸闷、气促症状进行性加重。因神经元特异性烯醇化酶(NSE)显著升高,2023 年 2 月再次行肺组织活检,病理确诊为大细胞神经内分泌癌(LCNEC)。免疫组化显示P40(-)、P63(-)、TTF-1(+)、CK7(-)、CD56(+)、Syn(+)、CgA(+),ALK(D5F3)及PD-L1(TPS 0%)阴性,Ki-67指数 95%+(图2B-E),提示靶向治疗后发生ASC向LCNEC的病理转化。
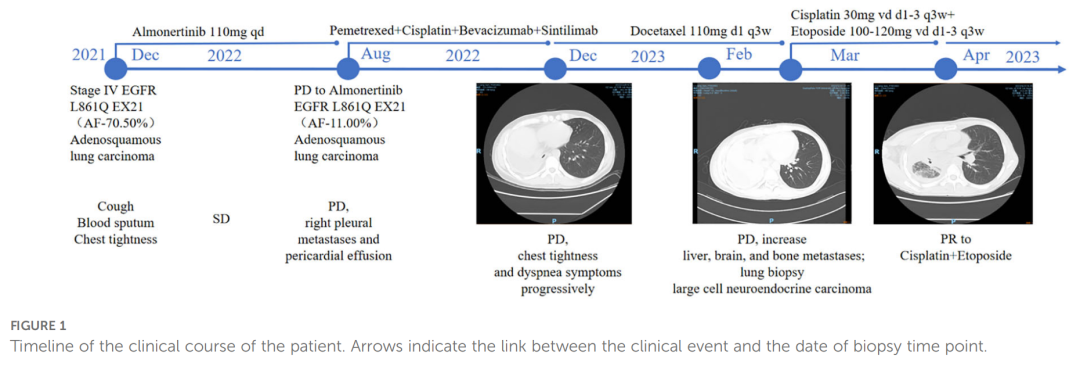
▲图1 患者临床病程的时间线
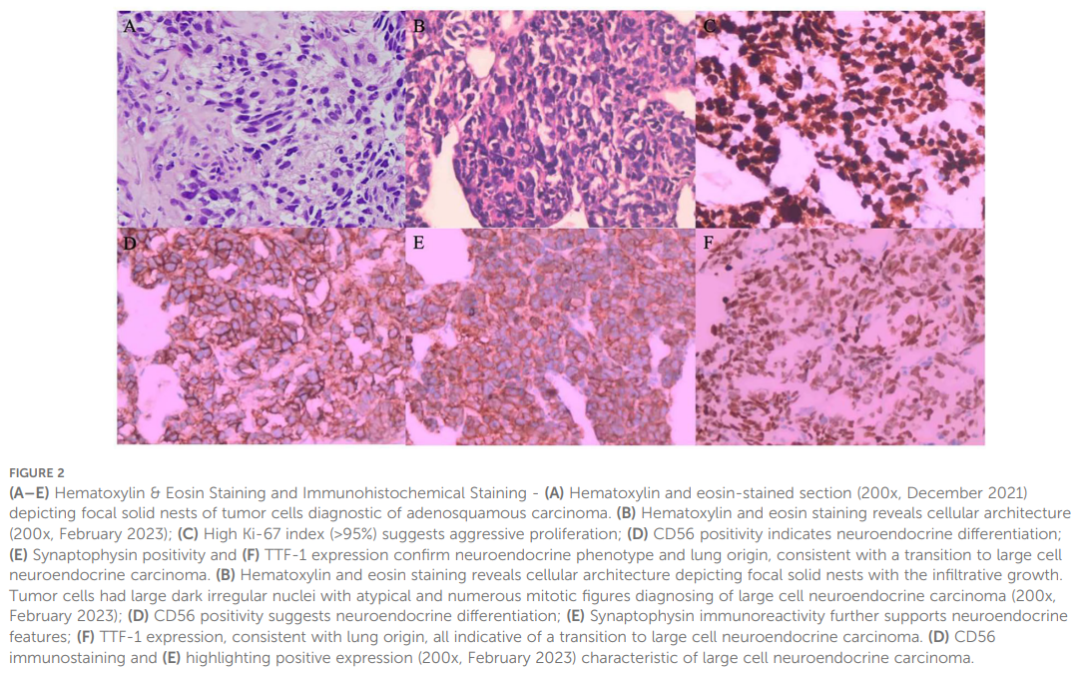
▲图2 HE染色和免疫组化结果
讨 论
据研究人员所知,这是首例报道的阿美替尼治疗后肺腺鳞癌(ASC)转化为大细胞神经内分泌癌(LCNEC)的病例。ASC作为非小细胞肺癌(NSCLC)的罕见亚型,其病理诊断标准要求肿瘤中同时存在腺体和鳞状细胞成分,且每种成分占比均超过 10%。相较于单纯腺癌或鳞癌,ASC通常表现出更强的侵袭性生物学行为,并与更差的临床预后相关。近期研究表明,ASC中的腺体和鳞状成分可能源于单一克隆事件,随后发生从腺癌向鳞状细胞癌的转分化。ASC患者EGFR突变发生率与肺腺癌相当,且携带EGFR突变的ASC患者对EGFR-TKI治疗具有良好应答。
阿美替尼是中国首个自主研发的第三代EGFR-TKI药物,其核心设计旨在克服T790M耐药突变。2022 年ESMO Asia大会报道的AIM研究纳入携带罕见EGFR突变的晚期非鳞状NSCLC患者,证实阿美替尼对除EGFR ex20ins外的罕见EGFR突变NSCLC患者一线治疗有效。相较于其他基因型,阿美替尼在携带G719X、L861Q及S768I突变患者中显示出更优的疗效。AENEAS研究结果显示,在EGFR突变局部晚期或转移性NSCLC患者的一线治疗中,阿美替尼较吉非替尼显著延长中位无进展生存期(PFS,19.3 个月 vs 9.9 个月)和缓解持续时间(DOR,18.1 个月 vs 8.3 个月),且安全性更优。
本病例中,患者确诊为EGFR L861Q阳性腺鳞癌(ASC)并接受阿美替尼治疗,但 8 个月后出现疾病进展。尽管第三代EGFR-TKI为EGFR突变NSCLC患者带来显著的生存获益,其耐药问题仍不可避免。II期临床研究显示,阿美替尼二线治疗的耐药机制以继发性EGFR突变(如顺式C797S及L718Q突变)和旁路信号激活(包括PIK3CA、JAK2、BRAF、KRAS突变,HER2扩增及FGFR3-TACC3融合)为主。本例患者疾病进展后行血液基因检测检出EGFR L861Q、EGFR L858M、RB1、TP53、PTEN及SMARCA4突变,结合重复活检确诊LCNEC的结果,可明确其耐药机制为向神经内分泌肿瘤的组织学转化,而非继发EGFR突变或旁路激活。
大细胞神经内分泌癌(LCNEC)与小细胞肺癌(SCLC)同属高级别神经内分泌肿瘤,二者具有相似的临床和基因组学特征,提示其转化通路可能存在相同之处。Ferre及Marcoux的研究显示EGFR突变腺癌发生表型转化的中位时间分别为 16 个月和 17.8 个月。腺癌向SCLC转化的可能机制包括:①肿瘤初发时即存在腺癌与SCLC成分共存,经TKI治疗后SCLC最终取代其他组织学类型;②SCLC除起源于肺神经内分泌细胞外,还可能源于其他肺上皮细胞,II型肺泡细胞具有向两种组织学分化的潜能,可能同时产生EGFR突变腺癌和SCLC;③TP53和RB1基因失活对SCLC发生具有诱导作用,而这两个基因的缺失正是SCLC的常见特征。此外,RB家族成员P107或P130缺失、MYC家族扩增、PTEN通路改变及BCL-2高表达均与SCLC细胞的生长、增殖和存活相关。肺基质及免疫微环境的改变也可能促进SCLC发生。其他可能参与组织病理转化的遗传通路包括NOTCH及ASCL1。ASCL1是NOTCH信号通路的下游靶点,研究表明NOTCH失活突变即可诱导非神经内分泌肿瘤细胞或肿瘤前体细胞向神经内分泌分化。尽管目前关于LCNEC转化机制的研究较少,但鉴于LCNEC与SCLC在临床及基因组学层面的相似性,研究人员推测其转化通路与SCLC具有相似性,值得进一步研究。值得注意的是,虽然腺癌向神经内分泌癌转化的机制已有较多研究,但腺鳞癌经EGFR-TKI治疗后转化为神经内分泌癌的具体机制仍需深入探索。
现有研究表明,携带EGFR/RB1/TP53三重突变的NSCLC患者更易发生向小细胞肺癌(SCLC)的组织学转化,尤其当伴随高频AID/APOBEC突变及基因组扩增时。本病例二次基因检测检出EGFR/RB1/TP53共突变,但令人遗憾的是,患者在EGFR-TKI治疗耐药后拒绝重复活检,转而接受"培美曲塞+顺铂+贝伐珠单抗+信迪利单抗"联合方案治疗3周期。由于肿瘤持续进展且神经元特异性烯醇化酶(NSE)水平显著升高,研究人员在EGFR-TKI治疗耐药后 6 个月行肺组织活检,最终确诊为大细胞神经内分泌癌(LCNEC)。目前LCNEC的治疗以化疗为核心,但最佳方案尚未达成共识,临床实践中常参考SCLC化疗方案。基于此,研究人员选择EP方案(顺铂+依托泊苷),经两个周期治疗后随访CT显示肿瘤整体退缩达部分缓解(PR),患者临床症状显著改善,证实该治疗方案的有效性。
本病例证实,向神经内分泌癌的组织学转化是阿美替尼获得性耐药机制之一,且EGFR突变在转化后的LCNEC中仍可能持续存在。明确组织学诊断及驱动基因突变对制定治疗决策至关重要。因此,研究人员建议对EGFR-TKI治疗耐药患者(尤其是携带EGFR/RB1/TP53共突变的NSCLC患者)及时行重复活检,以获取最佳治疗策略,从而进一步延长生存期并改善生活质量。针对EGFR/RB1/TP53突变,可优先考虑化疗方案。肿瘤转化后的神经内分泌癌对化疗仍能保持疗效。期待未来新型分子检测方法的进展,为早期识别转化风险提供技术支持。
参考文献:
Cheng K, Zhu Y, Sang R, Kuang Z, Cao Y. Case report: A patient with EGFR L861Q positive adenosquamous lung carcinoma transforming into large cell neuroendocrine cancer after treatment with Almonertinib. Front Oncol. 2025 Feb 18;15:1453066. doi: 10.3389/fonc.2025.1453066. PMID: 40040728; PMCID: PMC11876032.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#非小细胞肺癌# #阿美替尼#
37 举报