Nature Medicine:三重免疫密钥破局"脑癌之王":新疗法让患者17个月无复发
2025-03-01 生物探索 生物探索 发表于陕西省
《Nature Medicine》研究发现,手术前使用抗PD-1、抗CTLA-4和抗LAG-3的新辅助三联疗法,能大幅改变肿瘤微环境,使晚期患者实现17个月无复发存活,相关临床试验已启动。
引言
胶质母细胞瘤(Glioblastoma, GBM)始终是神经外科医生与肿瘤学家心头的一根刺。这种被称为“脑癌之王”的恶性肿瘤,患者确诊后的中位生存期仅14个月,五年存活率不足5%。更令人绝望的是,传统治疗“三板斧”——手术、放疗和化疗,在对抗MGMT启动子未甲基化(unmethylated MGMT promoter)这类高危亚型时几乎束手无策:即便接受全球标准的Stupp方案治疗,患者生存期也难以突破12个月。而曾被寄予厚望的免疫治疗,在GBM领域却屡屡折戟,PD-1单药临床试验全军覆没,甚至被贴上“免疫治疗黑洞”的标签。
然而,2月27日《Nature Medicine》的一项突破性研究“Neoadjuvant triplet immune checkpoint blockade in newly diagnosed glioblastoma”,为这片黑暗撕开了一道光——手术前使用三种免疫检查点抑制剂(ICIs)的“新辅助三联疗法”,竟让一名56岁的晚期GBM患者实现17个月无复发存活!研究团队大胆颠覆传统治疗时序,在肿瘤原位完整时注射抗PD-1(Nivolumab)、抗CTLA-4(Ipilimumab)和抗LAG-3(Relatlimab),仅12天后手术切除的肿瘤中,杀伤性T细胞数量暴涨8倍,83%的癌细胞竟主动“举起白旗”表达免疫识别信号(MHC分子)。更惊人的是,原本被视为“免疫荒漠”的肿瘤微环境中,活化T细胞占比从5%飙升至44%,颗粒酶B(Granzyme B)的“杀伤风暴”席卷癌巢。
这项研究不仅挑战了“血脑屏障阻隔大分子药物”的传统认知,更揭示了新辅助免疫治疗的独特优势:完整肿瘤释放的抗原如同“通缉令”,让免疫系统在手术前完成“敌我识别训练营”。而三药联动的协同效应,则像“三重加密钥匙”,同时解除T细胞的多重制动机制。目前,全球首个针对新诊断GBM的三联免疫治疗临床试验(GIANT, NCT06816927)已箭在弦上。这场医学奇迹是否预示着一场脑癌治疗的范式革命?答案或许就在不远的未来。

在医学界,胶质母细胞瘤(Glioblastoma, GBM)被称为"脑癌之王"。这种恶性脑肿瘤患者的中位生存期仅有14个月,五年生存率不足5%。然而,27日《自然·医学》杂志的这项突破性研究,为这道医学难题撕开了一道希望之光——通过手术前使用三种免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICIs),一名56岁的晚期GBM患者成功实现17个月无复发生存。这场医学奇迹背后,是对免疫系统的精妙操控,更是癌症治疗范式的革命性突破。
脑癌之王的致命困局:当传统疗法集体失效
胶质母细胞瘤:大脑中的"完美杀手"
胶质母细胞瘤的恐怖之处,在于它完美复刻了"癌细胞生存法则"。
快速增殖:GBM细胞的分裂速度是正常脑细胞的10倍,确诊时肿瘤直径往往已超5厘米
免疫逃逸:肿瘤微环境(Tumor Microenvironment, TME)中充斥着抑制性免疫细胞,如同为癌细胞打造"防弹衣"
血脑屏障庇护:传统化疗药物难以穿透这道天然屏障,90%的化疗方案宣告失效
更令人绝望的是,约60%的GBM患者属于"MGMT启动子未甲基化"亚型——这意味着癌细胞能快速修复化疗药物造成的DNA损伤,使替莫唑胺(Temozolomide)等一线化疗药彻底失效。这类患者的中位生存期仅有10.6个月,比甲基化型患者短40%。
免疫疗法的"滑铁卢"
当PD-1抑制剂在黑色素瘤、肺癌等领域大放异彩时,GBM却成为免疫治疗的"黑洞"。既往临床试验显示:
术后使用PD-1单药(如纳武利尤单抗)的患者,生存期与安慰剂组无差异
放疗联合PD-1治疗未能突破生存瓶颈
复发患者中,仅有0.3%对免疫治疗产生响应
问题根源直指GBM的三大免疫屏障:
T细胞荒漠——肿瘤浸润淋巴细胞(Tumor-Infiltrating Lymphocytes, TILs)数量不足正常脑组织的1/100
免疫抑制微环境——巨噬细胞/小胶质细胞占比超80%,持续分泌TGF-β等抑制因子
低肿瘤突变负荷(TMB)——平均仅2突变/Mb,远低于黑色素瘤的15突变/Mb
破局时刻:新辅助三联疗法的三重奏
治疗时序的革命:为什么要在手术前用药?
传统免疫治疗多在术后或复发后使用,但此时:
手术创伤引发炎症风暴,破坏免疫稳态
残留癌细胞已建立新的免疫抑制网络
长期使用地塞米松等激素进一步压制免疫力
新辅助治疗(Neoadjuvant Therapy)的颠覆性在于:
保留完整肿瘤抗原:原位肿瘤释放大量新抗原,犹如为免疫系统绘制"通缉令"
突破血脑屏障:术前血供完整,药物更易渗透至肿瘤核心
时间窗口优势:在放疗/化疗损伤免疫系统前激活T细胞
三药联用的精妙协同
研究团队选择了PD-1抑制剂(纳武利尤单抗)+CTLA-4抑制剂(伊匹木单抗)+LAG-3抑制剂(瑞拉利单抗)的黄金组合:
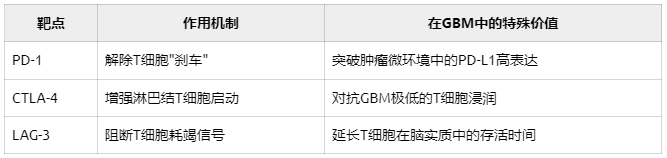
动物实验显示:三药联合可使TILs数量提升300%,疗效是单药的5倍。这种协同效应在低TMB肿瘤中尤为显著。
奇迹案例:56岁患者的治愈之路
病情全记录
患者男性,56岁,因癫痫发作就诊:
基线特征:左颞叶IDH野生型、MGMT未甲基化GBM,RTK2分子亚型
基因组图谱:EGFR扩增、PTEN纯合缺失、TERT启动子突变——三重高危因素
治疗流程:
确诊后第4天接受肿瘤活检
第1天静脉注射三药联合疗法(纳武利尤单抗480mg+伊匹木单抗80mg+瑞拉利单抗160mg)
第13天进行最大安全范围切除
术后接受放疗(60Gy/30次)和个性化肽疫苗
免疫系统的"震撼动员"
治疗前后肿瘤微环境对比:
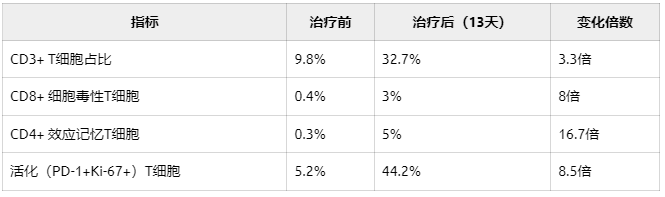
更惊人的是,颗粒酶B(GzmB)+细胞占比达91%——这意味着杀伤性T细胞已进入"战斗状态"。单细胞测序显示,治疗后T细胞受体(TCR)克隆多样性提升6倍,83.8%的肿瘤细胞表达MHC-I分子,为免疫识别铺平道路。
机制揭秘:三重免疫激活的分子交响
第一重:打破血脑屏障的"特洛伊木马"
传统观点认为,大分子抗体难以穿透完整血脑屏障。但该研究发现:
术后肿瘤中检测到高浓度纳武利尤单抗,证实抗体成功渗透
T细胞表面的PD-1受体被药物完全占据(Occupancy Rate >95%)
循环肿瘤细胞(CTCs)从16个/7.5ml血液降至0
这提示:活化的T细胞本身成为"药物载体",通过主动迁移将抗体带入脑实质。
第二重:改写肿瘤微环境的"生态革命"
多重荧光染色显示:
巨噬细胞/小胶质细胞与肿瘤细胞的共定位减少70%
树突状细胞(DCs)数量增加4倍,抗原呈递能力提升
IFN-γ、CXCL9等趋化因子表达上调300%
此时的肿瘤微环境从"免疫沙漠"转变为"炎症热土",为后续放疗/疫苗打下基础。
第三重:系统免疫的"记忆形成"
外周血分析发现:
循环T细胞中Ki-67+增殖群体从3%飙升至81%
OX40、MHC-II等活化标志物表达提升10倍
TCR克隆多样性指数(Shannon Index)增加4倍
这表明,新辅助治疗不仅激活局部免疫,更在全身建立长效免疫记忆,形成"抗癌预备队"。
未来:GBM治疗的新纪元
GIANT临床试验启航
基于该研究,全球首个新辅助三联免疫治疗试验(GIANT, NCT06816927)即将启动:
入组标准:新诊断MGMT未甲基化GBM,KPS≥70
治疗方案:术前3周三药联合→最大切除→辅助放疗+个体化疫苗
主要终点:24个月总生存率(OS)
个体化治疗的四大方向
生物标志物分层:通过TMB、PD-L1 CPS评分筛选优势人群
给药时序优化:探索双周期新辅助治疗的增效潜力
局部给药创新:瘤腔内缓释剂型提升药物浓度
联合放疗增敏:利用免疫治疗的"远隔效应"清除微转移灶
改写癌症治疗史的启示
这项突破带给医学界的思考远超GBM本身:
时机决定成败:在肿瘤原位激活免疫,比术后"亡羊补牢"更有效
组合优于单药:多重免疫检查点的协同阻断能克服耐药
脑部非免疫豁免区:合理设计下,系统免疫可穿透血脑屏障
当56岁的患者术后第526天复查MRI,看到稳定的影像学表现时,这场抗癌战役已不仅是医学的胜利,更是对人类勇气的礼赞。
免疫治疗的三重奏,正在谱写脑癌治疗的新乐章。或许在不远的未来,"脑癌之王"的称号,终将成为历史。
参考文献
Long, G.V., Shklovskaya, E., Satgunaseelan, L. et al. Neoadjuvant triplet immune checkpoint blockade in newly diagnosed glioblastoma. Nat Med (2025). https://doi.org/10.1038/s41591-025-03512-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#胶质母细胞瘤# #免疫检查点抑制剂#
30