方案与建议|难治性精神分裂症中国专家共识(2025)
2025-05-27 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于上海
共识制定过程中同时结合了循证证据,有助于规范和指导中国成年难治性精神分裂症患者的诊疗。
摘 要 难治性精神分裂症是精神科临床的难点与重点,约20%~40%患者经过数种抗精神病药物足量足疗程治疗仍疗效不佳,最终被诊断为难治性精神分裂症。氯氮平是目前难治性精神分裂症的标准治疗手段。早期识别和规范化治疗有助于难治性精神分裂症患者尽快控制症状、降低自杀率、提高生活质量。本共识在指导委员会的指导下,经过30位精神科专家反复讨论及改良德尔菲(Delphi)法匿名调研,最终形成了17项针对难治性精神分裂症的共识意见,涉及危险因素及预防、诊断及评估、氯氮平规范化治疗方案、不良反应处理、氯氮平抵抗及不能耐受时的治疗方案以及心理社会干预等多个方面。共识制定过程中同时结合了循证证据,有助于规范和指导中国成年难治性精神分裂症患者的诊疗。
关键词
精神分裂症;难治性精神分裂症;治疗抵抗;氯氮平;专家共识
1988年KANE等[1]首次提出了“难治性精神分裂症(treatment-resistant schizophrenia,TRS)”的概念,随着抗精神病药物的逐步发展,TRS的概念不断变迁,其核心是经数种抗精神病药物足量足疗程治疗仍疗效不佳,提示患者对绝大多数抗精神病药物不敏感。一项meta分析表明,精神分裂症患者中TRS的患病率约为36.7%,其中首发精神病队列中TRS患病率约为22%,多次发作患者中约为39.5%[2]。目前,氯氮平是TRS患者的标准治疗手段[1, 3-4]。若患者经氯氮平足量足疗程治疗仍无效,则称为“氯氮平抵抗性精神分裂症(clozapine-resistant schizophrenia,CRS)”,临床上也习惯称为“超难治性精神分裂症(ultra-treatment-resistant schizophrenia)”,约占全部TRS患者的40%~70%[5]。与缓解期患者相比,TRS患者自杀率更高、生活质量更低[6]、治疗花费更多[7],是精神科临床工作的难点与重点。然而,我国难治精神分裂症诊治尚缺少规范化标准,临床用药中存在较多不合理情况,例如TRS诊断及氯氮平使用不足与延迟、氯氮平剂量不足、不合理联合用药等,亟待改进。本共识集合我国精神科领域相关专家意见,同时结合循证证据,对TRS的预防、诊断、评估和治疗提出建议,旨在规范我国TRS诊治流程,为相关患者的管理提供指导,加强基层医疗机构、综合医院与精神专科医院之间的协作互动,共同改善TRS患者的症状控制、功能预后和生存质量。为明确目标人群,本共识主要关注以幻觉、妄想等阳性症状为主的TRS,而暂不涉及以阴性症状及认知症状为主的TRS。
1 共识形成过程
本共识由中华医学会精神医学分会精神分裂症协作组、上海市神经科学学会精神医学分会发起,上海交通大学医学院附属精神卫生中心刘登堂教授和广州医科大学附属脑科医院郑英君教授联合牵头组织,专家共识意见的形成采用改良德尔菲(Delphi)法,通过2轮匿名投票表决及反馈修改形成最终意见。本共识已在国际实践指南注册与透明化平台完成注册(注册号:PREPARE‐2024CN1166)。来自国内不同地区的5位精神科医生组成指导委员会(含1位方法学专家),负责指导共识形成的全过程,共同提名了参与匿名投票的专家组及参与共识成文的工作组。投票使用Likert五点法,分为“1‐强烈反对,2‐反对,3‐中立,4‐同意,5‐强烈同意”,若持“强烈反对+反对”或“强烈同意+同意”态度的专家比例≥70%,则认为达成共识,形成专家推荐意见。循证证据评级方面,本共识使用澳大利亚乔安娜布里格斯研究所(Joanna Briggs Institute,JBI)证据预分级及证据推荐级别系统,对不同类型的临床证据进行质量等级评定(表1)[8]。最终,共有30位来自全国各省市的专家参与匿名调研,均为副高级及以上职称。第一轮问卷回收率为100%,第二轮回收率为93%。指导委员会、专家组及工作组成员均不存在与本共识相关的利益冲突。
Tab.1 JBI evidence pre-grading and evidence recommendation level system
表1 JBI证据预分级及证据推荐级别系统

首先,工作组以(schizophrenia OR psychosis OR psychotic)AND(resistant OR refractory)作为英文检索式,(精神分裂症)AND(难治性 OR 氯氮平 OR 治疗抵抗)作为中文检索式,按照研究对象、干预措施、对照措施、研究结局(participants, interventions, comparisons, outcomes, PICO)原则组合后,在PubMed、Embase、知网与万方等国内外多个数据库进行系统文献检索与筛选,检索时间截至2025年1月。在循证证据基础上,指导委员会结合临床需求初步提炼出TRS相关的五大临床问题,形成第一轮调研问卷,共包含17项推荐意见、30个子条目。根据第一轮反馈结果,有23个子条目达成共识,而7个子条目未达成共识。指导委员会及工作组成员经过讨论及进一步补充证据后,删去未达成共识的6个子条目,修改1个子条目的表述(长效针剂相关),增加1项推荐意见(联合用药相关),同时由于证据不足删除2个已达成共识的子条目(联合用药相关)。第二轮调研问卷共包含2项推荐意见、4个子条目。根据第二轮反馈结果,有2个子条目达成共识,而2个子条目未达成共识。最终共形成17项推荐意见。图1为专家共识意见形成流程图。在形成推荐意见的过程中,根据指导委员会成员的意见进行多次反馈修改及循证证据的补充检索。
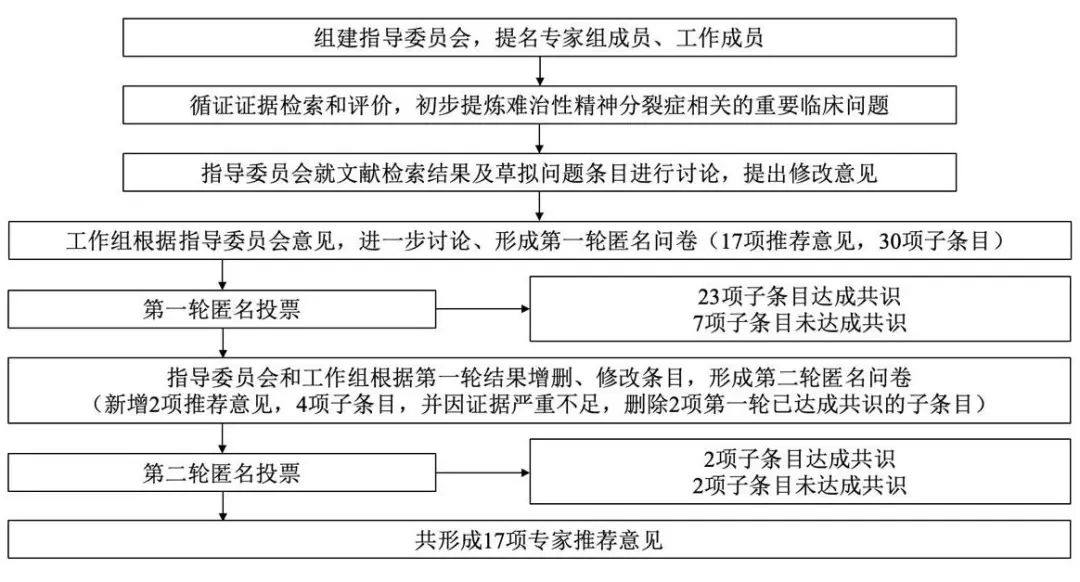
Fig.1 Flowchart of expert consensus formation
图1 专家共识意见形成流程图
2 TRS相关临床问题及专家建议
临床问题1 TRS的危险因素及预防
推荐意见1 TRS的危险因素包括起病年龄小、病前受教育水平低、病前社会功能低、精神病未治疗时间长、自杀未遂史、首次发作持续时间长、急性期症状较重、早期复发、复发及住院次数多、总病程较长、治疗依从性差、合并人格障碍及物质滥用等。(专家共识度100%,证据等级1a~4b)
精神分裂症患者发展为TRS具有一定风险因素。SMART等[9]纳入12项前瞻性纵向研究的系统综述发现,起病年龄小是首发精神分裂症患者进展为TRS最一致的预测因素,其余因素仅在个别研究中具有显著性:男性、受教育程度低、精神病未治疗时间长、急性期症状较重、维持治疗抗精神病药物联合用药、维持治疗依从性良好但仍复发、首次发病3年内复发、合并人格障碍、有自杀未遂史等[9](证据等级1a)。另一项系统综述发现,首发精神分裂症后续发展为TRS的危险因素有起病年龄小、病前社会功能低、受教育程度低、首次发病阴性症状明显、共病物质滥用、治疗依从性差、治疗早期疗效不佳、精神病未治疗时间长[10](证据等级1a)。一项涉及45个国家的meta分析提示,患者年龄较大和社会功能较差与TRS风险相关[2](证据等级1a)。CHAN等[11]的巢式病例对照研究在中国香港对450例首发精神分裂症谱系障碍患者进行12年随访,发现起病年龄较小、病前社会适应能力较差、首次发作持续时间较长、复发次数较多、前2年的抗精神病药物剂量较高,这些因素与TRS的提前发生有关[11](证据等级4b)。
推荐意见2 药物治疗不规范会增加TRS风险,如单药治疗不规范(剂量或疗程不足)、多药联合治疗不规范(盲目选择多种抗精神病药物联合治疗)、维持治疗不规范(过早停药或减量);对不良反应识别及处理不足会增加TRS风险。(专家共识度100%,证据等级1a~4c)
药物治疗不规范可能与诸多TRS危险因素相关,从而间接增加TRS风险。
急性期治疗不规范可能导致发作持续时间延长。LEUCHT等[12]的meta分析提示,合适的抗精神病药物剂量有助于急性期患者尽快达到疾病缓解(证据等级1a),且不同指南均建议在达到治疗剂量后进行一段时间观察,以准确评估疗效[13]。维持治疗则有助于预防疾病复发及再住院。几项大样本meta分析发现,精神分裂症急性期后停药或安慰剂治疗,其复发及再住院率显著高于维持治疗[14-17](证据等级1a),且原剂量维持治疗优于减量治疗[15-16, 18-19](证据等级1a)。
目前,精神分裂症遵循单药治疗原则。一项meta分析发现,联合用药在症状偏重患者中更常见,但并未扭转其预后,联合用药患者复发及再住院风险更高,同时不良反应更多、死亡率更高[20](证据等级1b)。另一项meta分析显示,抗精神病药物联合用药并未带来阳性症状缓解的获益,而总体症状缓解的获益主要来自联合阿立哌唑对阴性症状的改善[21](证据等级1b)。TIIHONEN等[4, 22]基于丹麦及瑞典国家队列开展研究,以再住院率为观察指标,发现部分联合治疗方案优于单药治疗(证据等级4c),但尚无更高级别证据支持这一结论。综上,多种抗精神病药物联合治疗获益不明,同时可能导致更多不良反应,进而增加TRS风险,因此目前仅适用于少数氯氮平抵抗或不能耐受患者。
此外,几项系统综述均发现,不良反应是导致治疗依从性降低的主要原因[23-25](证据等级4a),因此对不良反应识别及处理不足可能间接增加TRS风险。
临床问题2 TRS的评估
推荐意见3 建议回顾病史及诊疗经过,进行详细的体格检查及精神检查,完善实验室及辅助检查,再次明确精神分裂症诊断,排除器质性精神障碍或其他原发性精神障碍,必要时多学科会诊。(专家共识度100%,证据等级4a~5c)
目前大部分精神障碍诊断仍依赖主观的症状学检查,因此需要排除误诊导致的抗精神病药物疗效不佳。工作组及专家委员会讨论认为,对于TRS具有临床重要性的鉴别诊断主要包括原发性精神障碍中的双相障碍、抑郁障碍和强迫及相关障碍[26-28](证据等级5c),以及器质性精神障碍中的自身免疫性脑炎和多发性硬化等[29-33](证据等级4a~5b)。
伴有精神病性症状的抑郁障碍和双相障碍与精神分裂症鉴别主要通过详细的病史采集与精神检查。一篇综述提出,强迫障碍与精神分裂症谱系障碍的症状存在重叠,例如强迫观念和强迫行为可能与某些妄想信念和相应的回避行为表现类似,且最新的诊断系统(如ICD-11、DSM-5)定义了缺少抵抗和自知力的强迫障碍标注,使得两种疾病的界限更为模糊,同时,精神分裂症可能共病强迫障碍,因此需要临床医生认真分析鉴别[28](证据等级5c)。
自身免疫性脑炎临床上可表现为突出的精神病性症状,部分患者被误诊为精神分裂症,多为难治性病例,近年来受到越来越多的关注。一项专家共识[29](证据等级5b)和3篇综述[30-32](证据级别5c)总结了两者的鉴别诊断重点,当患者临床表现为急性起病的精神病性症状、症状多样而不典型,或同时发现肿瘤诊断,以及存在明显认知功能障碍、意识清晰度下降、神经系统定位体征、紧张症、新发癫痫、肌张力异常或自主神经功能不稳定,或脑电图、磁共振检查存在异常时,应高度怀疑自身免疫性脑炎,进一步完善血清抗体及脑脊液检查。POLLAK等[33]的meta分析发现,临床诊断为精神分裂症谱系障碍的患者中,N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体抗体阳性率约7.98%,其中临床相关性较高的IgG抗体亚型阳性率约1.46%(证据等级4a)。SABE等[34]的系统综述则总结了首发表现为精神病性症状的多发性硬化患者的临床特征,发现患者出现精神病性症状比确诊多发性硬化平均提早了2.7年,主要症状包括妄想、幻视及幻听等,头颅影像学检查显示弥漫性脑室周围病变,且免疫抑制剂对精神症状的改善显著优于抗精神病药物[34](证据等级4a)。
推荐意见4 详细了解个人史及既往史,完成智商及人格测评,明确患者是否存在神经发育障碍或人格障碍;了解患者是否共病精神活性物质使用障碍(包括酒精)。(专家共识度97%,证据等级3a~4a)
神经发育状态和人格特质可能从不同维度影响TRS的发生与疗效,需要进行评估。一项基于全基因组关联分析(GWAS)数据的meta分析将精神分裂症分为神经发育异常和成年突触修剪异常2组,前者与更差的神经认知和更低的受教育程度相关[35](证据等级4a)。DI LUZIO等[36]的系统综述同样发现,早发型精神分裂症患者(13岁前发病)合并神经发育障碍比例更高(证据等级4a)。发病年龄小、受教育程度低均是TRS的高危因素。合并人格障碍和物质滥用同样是TRS的高危因素。精神病性障碍患者共病人格障碍的比例在不同研究中差异很大(4.5%~100%)[37](证据等级4a),对待治疗的正面态度和良好的治疗关系是抗精神病药物治疗依从性较好的相关因素[24-25](证据等级4a),人格障碍患者可能在上述因素中存在劣势,间接增加TRS风险。尽管暂无更高级别证据表明TRS与智能状态或人格特质的联系,但神经发育状态和人格特质具有长期、不易改变的特征,可能导致治疗效果欠佳。
一项meta分析发现,精神分裂症患者共病物质使用障碍比例高达41.7%,其中共病酒精使用障碍的比例约为24.3%,欧美国家上述比例相对更高[38](证据等级3b),另一项meta分析则提示共病物质使用障碍(包括酒精)与精神分裂症患者更高的死亡率显著相关[39](证据等级3a)。一项美国真实世界观察性研究(CATIE研究)发现,精神分裂症患者共病中/重度物质使用障碍者与轻度/不使用者相比,治疗后精神病性症状缓解更少,抑郁症状更多,生活质量更差[40](证据等级3b)。
推荐意见5 对既往抗精神病药物治疗的充分性及依从性进行评估:
①患者至少接受过两种化学结构不同抗精神病药物分别足量(≥600 mg/d氯丙嗪当量)、足疗程(每种药物达到治疗剂量连续6周以上)序贯治疗。(专家共识度93%,证据等级1b~4b)
②对患者治疗依从性进行充分评估,可以通过药片计数(服用≥80%的药物处方剂量)、诊疗记录或照料者记录来判断依从性;对患者药物生物利用度进行评估,包括食物-药物及药物-药物相互作用,必要时进行血药浓度监测。(专家共识度100%,证据等级1b~4b)
③如果无法确认依从性,无法确保患者是否经过足量足疗程治疗,可以考虑使用一种抗精神病药物长效针剂。(专家共识度86%,证据等级1b)
如果精神分裂症患者症状控制欠佳是由于耐受性差或依从性差而导致不能足量足疗程使用药物,则应视为药物治疗不充分,而不应诊断为TRS/CRS。因此,在TRS诊断前,需谨慎评估既往抗精神病药物是否足量足疗程。
上述推荐意见中①和②经过第一轮调研均达成共识。其中,抗精神病药物剂量方面,本共识采取600 mg/d氯丙嗪等效剂量作为诊断TRS前足量治疗的要求,因其为抗精神病药物治疗剂量国际共识推荐的目标治疗剂量300~600 mg/d氯丙嗪等效剂量的高值[41](证据等级1b),同时位于绝大多数临床指南推荐的300~1000 mg/d氯丙嗪等效剂量的中位[13](证据等级5a)。疗程方面,一篇较早的meta分析发现,抗精神病药物的疗效通常从第1周就出现,初始2周的症状改善较第3~4周更为明显[42](证据等级1b);另一篇meta分析显示,精神分裂症急性期开始抗精神病药物治疗,前4周症状缓解呈线性下降趋势,在4~6周逐渐趋平[43](证据等级1b)。尽管随机对照试验(randomized controlled trial,RCT)研究提示少部分精神分裂症患者的症状需8~12周达到有效标准[44](证据等级1c),但绝大部分患者6周后继续治疗无更多获益。因此,将6周作为TRS诊断前每种药物足疗程标准较为合理。
TRS诊断前需要经过几种以及何种抗精神病药物序贯治疗,尚有争议。GRIFFITHS等[45]的系统综述发现,使用氯氮平前曾尝试的抗精神病药物种类越少,氯氮平疗效越好(证据等级3b)。尝试过多种类抗精神病药物可能延迟TRS诊断及氯氮平使用,不利于疾病缓解。本共识采用两种化学结构不同的抗精神病药物治疗作为诊断TRS前评估标准,获得大部分专家认可。临床常用抗精神病药物对于急性期阳性症状的改善程度存在一定差异,LEUCHT等[47]发现氯氮平、氨磺必利、奥氮平、利培酮与部分其他药物相比具有显著优势,HUHN等[48]发现对于阳性症状改善较多的前5位药物为氨磺必利、利培酮、氯氮平、奥氮平、帕利哌酮(证据等级1a)。因此,专家组认为TRS诊断前应要求至少经过两种对阳性症状作用较强的抗精神病药物治疗(见推荐意见6 TRS的诊断标准)。
治疗依从性差是导致患者全因治疗中断率升高的危险因素,也是首发精神分裂症后续发展为TRS的危险因素[10, 49]。依从性评估方式包括药片记录、诊疗记录、照料者记录、血药浓度监测及电子药物监测工具等。一项基于电子药物监测的meta分析发现,口服抗精神病药物按照服用80%处方药物判定,依从比例为50%~75%,依从性不佳的相关因素包括疗效不佳、自知力欠缺、每日服药次数多、不良反应多[50](证据等级1b),因此TRS患者极易出现依从性不佳。血药浓度监测的优势在于其客观性,但需要反复监测以确定患者长期服药依从性,一项前瞻性队列研究定义血药浓度变化小于30%为治疗依从性良好,但与患者报告及医生评估的依从性均无相关性[51](证据等级4b),提示血药浓度监测在评估依从性方面亦存在局限性。
药物生物利用度是影响疗效的另一重要因素。抗精神病药物大多通过细胞色素P450系统代谢,共用促酶药物可能降低抗精神病药物的生物利用度,导致治疗不充分[52](证据等级1b),可使用药物相互作用平台“药物-药物相互作用数据库(DDInter)”等工具,评估其他药物对所使用的抗精神病药物生物利用度的影响,辅助临床决策[53]。目前,尚无充分证据表明P450酶的药物遗传性基因检测有利于指导抗精神病药物的使用[54-55](证据等级4a)。香烟中的多环芳烃可促进CYP450 1A2分泌,导致奥氮平和氯氮平加速降解,降低生物利用度[56](证据等级4a);鲁拉西酮与齐拉西酮需与食物同服,否则其生物利用度会降低[57-58](证据等级4a)。
近年来,抗精神病药物长效针剂的临床应用逐渐普及,本条推荐意见③涉及长效针剂在TRS诊断评估中的地位。在第一轮调研中,该条表述为“建议至少使用过一种抗精神病药物长效针剂”,未形成共识,故经专家组及指导委员会讨论后修改为目前表述,经第二轮调研达成共识。OKOLI等[59]的meta分析对比发现,抗精神病药物长效针剂可显著提高精神分裂症患者依从性,从而促进症状缓解,降低复发再住院风险(证据等级1b)。本共识调研结果同样显示,抗精神病药物长效针剂主要在确保依从性上存在优势,与国际精神病性障碍治疗效果与治疗抵抗(Treatment Response and Resistance in Psychosis,TRRIP)工作组制定的TRS操作性界定标准中的“较高标准”描述一致[60]。
临床问题3 TRS及CRS的诊断标准
推荐意见6 TRS的诊断标准:①符合精神分裂症诊断标准;②经过至少两种不同化学结构、对阳性症状具有较强疗效的抗精神病药物足量(≥600 mg/d氯丙嗪当量)、足疗程(每种药物达到治疗剂量连续治疗6周以上)序贯治疗,且治疗依从性较好;③当前存在明显的精神病性症状,量表评定为中等及以上;④社会功能受损,标准化量表评定为中度及以上。(专家共识度93%,证据等级5b)
共检索到8篇与TRS诊断标准相关的文献,其中,由TRRIP工作组制定的操作性界定标准认可度最广。该文系统综述1980-2016年42项随机对照研究中的TRS诊断标准,并采用Delphi法对各项条目达成专家共识,包括症状严重程度、既往治疗充分性、症状维度和疾病阶段4个方面的评估[60](证据等级5b)。中华医学会精神医学分会精神分裂症协作组考虑到TRS定义的变迁和可操作性,对上述TRS诊断标准进行了调整,并将于第3版《中国精神分裂症防治指南》中更新[61],本共识采纳该版本的TRS诊断标准。
推荐意见7 CRS的诊断标准:TRS患者经氯氮平单一药物足量足疗程治疗无效。氯氮平足量足疗程治疗标准如下:①氯氮平治疗剂量≥400 mg/d(如患者不能耐受,氯氮平剂量标准可个体化,但需充分治疗);②如可以监测浓度,建议氯氮平血药浓度≥350 ng/mL;③氯氮平达到治疗剂量连续治疗≥3个月。(专家共识度93%,证据等级1b)
氯氮平的具体治疗剂量及疗程见“专家意见10”,本条仅作为CRS诊断的最低标准。SCHULTE等[62]一项旨在明确何为氯氮平充分治疗的meta分析发现,大部分研究将氯氮平400 mg/d作为基础目标剂量,并在此基础上根据疗效、耐受性和血药浓度动态调整,然而氯氮平血药浓度受到性别、年龄、吸烟、共用药物等多种因素影响,在同等剂量下差异很大,因此足剂量的标准需个体化[62](证据等级1b)。另有一项meta分析发现氯氮平剂量>400 mg/d时,才显示出相比于利培酮的显著优势[63](证据等级1b)。SCHULTE等[62]的meta分析也提供了血药浓度及治疗时长最低标准的主要依据,氯氮平血药浓度<350 ng/mL者治疗有效率显著低于>350 ng/mL者,因此要求CRS诊断时血药浓度至少达到该最低标准[62](证据等级1b),但目前尚缺乏中国或亚洲人群中的血药浓度界限值。治疗时长方面,大部分氯氮平治疗有效患者在滴定至治疗剂量后的8周内达到有效标准,延迟响应可能与未继续向上滴定剂量有关[62](证据等级1b)。综合讨论后,本共识将达到治疗剂量连续治疗≥3个月作为CRS诊断的界定标准。
临床问题4 TRS的治疗方案
推荐意见8 TRS患者首选氯氮平治疗,一旦确诊,尽早启动氯氮平治疗。(专家共识度83%,证据等级1a~4b)
推荐意见9 经过其他药物治疗后,如果患者仍存在明显的自杀风险,或存在明显的攻击行为风险,推荐使用氯氮平治疗。(专家共识度97%,证据等级1b~4c)
多国指南[64-69]均推荐氯氮平作为TRS的一线治疗,并且建议一旦确诊患者为TRS,应尽早开始使用氯氮平治疗。SISKIND等[3]的meta分析发现,氯氮平的使用可以有效缓解TRS患者的阳性症状(证据等级1a),最高缓解率可达80%[70](证据等级4b),并有效降低12~24个月的住院率[71-72](证据等级3a)。日本回顾性队列研究表明,在出现治疗抵抗后2.8年内开始服用氯氮平治疗,其症状缓解率达82%,而在2.8年以后才使用氯氮平的缓解率仅有31%[46](证据等级4b)。MASUDA等[71]的系统综述显示,使用氯氮平可将住院风险降低18%,全因停药风险降低27%,且锥体外系症状(extra pyramidal symptoms,EPS)或抗胆碱能药物的使用风险降低36%(证据等级3a)。氯氮平与其他抗精神病药物相比可显著降低TRS患者总死亡率[39, 73](证据等级2b),未使用氯氮平治疗与近2倍的死亡风险相关[74](证据等级 4b)。
一项较早的meta分析发现长期使用氯氮平治疗的患者,其总的自杀行为风险较其他抗精神病药物长期治疗的患者低(RR=3.3)[75](证据等级1b)。2002年,氯氮平被美国食品药品监督管理局批准用于治疗具有严重自杀倾向的精神分裂症患者[76]。丹麦及芬兰全国性随访队列同样发现,接受氯氮平治疗的精神分裂症患者的自伤及自杀风险最低[74, 77](证据等级4c)。MASDRAKIS等[78]对既往大量研究进行系统综述,结果与上述研究相仿,即氯氮平可以有效预防精神分裂症患者自杀,而停用氯氮平则与自杀风险增加相关(证据等级1b)。多项综述发现氯氮平在精神分裂症患者和其他精神病中均可降低患者暴力攻击风险,且其改善效果较其他抗精神病药物更强[79-80](证据等级1b)。一项较新的回顾性研究发现氯氮平对精神分裂症患者的难治性攻击行为显示出有效性及安全性[81](证据等级3d)。
推荐意见10 氯氮平治疗方案:①目标治疗剂量为300~450 mg/d,最大剂量不超过900 mg/d;②血药浓度≥350 ng/mL;③达到治疗剂量后治疗时间至少8周。要充分考虑个体化差异,部分患者可能无法达到较高治疗剂量,部分患者治疗应答时间较长(如3~6个月)。(专家共识度97%,证据等级1b~3d)
《神经精神药理学治疗药物监测共识指南》(2017更新版)提供的氯氮平目标剂量为350~600 mg/d[82]。美国精神医学学会(American Psychiatric Association,APA)指南基于药品说明书推荐,TRS患者氯氮平初始治疗目标剂量为300~450 mg/d,部分患者可能需要在600 mg/d以上的剂量方可获得疗效,极少数患者甚至需高达900 mg/d的剂量方能达到完全反应[66](证据等级1c)。需要注意,我国氯氮平药品说明书最大剂量为600 mg/d,当评估患者需要超说明书剂量使用氯氮平时,需按照超说明书用药的规范使用,并密切评估患者的药物不良反应,动态评估获益与风险。氯氮平有效剂量存在较大个体化差异,DE LEON等[83]基于循证证据制定的氯氮平治疗指南提出,氯氮平代谢受到人种、性别、吸烟、肥胖、合并用药等因素影响,而亚洲人群往往在更低的氯氮平治疗剂量下即可达到目标血药浓度。SCHULTE等[62]较早的meta分析发现,当氯氮平的血药浓度<350 ng/mL时,仅约28%的TRS患者症状好转,但当血药浓度>350 ng/mL时,有约69%的患者获得临床改善(证据等级1b),这一结果也被《神经精神药理学治疗药物监测共识指南》(2017更新版)所推荐[82]。
氯氮平疗效观察需要较长时间。2项系统综述发现,使用氯氮平治疗的患者在6周时仍存在阳性与阴性症状量表(positive and negative syndrome scale,PANSS)得分显著下降的趋势(其他抗精神病药物已趋平),应继续观察疗效[84-85](证据等级1b)。SCHULTE等[62]的meta分析发现,尽管大部分有效患者的响应时间在达到个体化治疗剂量的8周内,但存在部分患者延迟6~12个月才响应(证据等级1b)。部分患者治疗应答时间可能更长,2025年一项印度的回顾性研究发现初期(3个月内)对氯氮平无反应的TRS患者,约34.2%在1年后获得临床改善[86](证据等级3d)。综上,建议至少尝试达到氯氮平治疗剂量连续3~6个月,若仍没有明显获益,可尝试其他方案。这一结论同样被英国指南支持[87]。
推荐意见11 氯氮平治疗药物不良反应监测,如镇静、嗜睡、癫痫发作、心动过速、体位性低血压、血脂升高、体重增加、糖耐量受损、便秘、肠梗阻、唾液分泌过多及肺炎等。尤其需要监测白细胞及中性粒细胞:①首次使用氯氮平前应完善血常规检查;②开始使用氯氮平治疗18周内,建议每周复查一次白细胞及中性粒细胞,第19周至第12个月,建议每月复查一次白细胞及中性粒细胞;③如果患者出现白细胞及中性粒细胞下降,则加强血象监测,使用粒细胞集落刺激因子等药物治疗,预防感染,调整抗精神病药物治疗方案,必要时邀请多学科会诊。(专家共识度97%,证据等级2a~5b)
氯氮平属于多受体药物,可以引起多个系统的不良反应:血液系统可能出现白细胞减少症、粒细胞缺乏症;中枢神经系统症状,如镇静、嗜睡、眩晕、癫痫发作;心血管系统可表现为心动过速、心肌炎、心肌病等;内分泌系统及代谢相关问题,如血脂升高、体重增加、葡萄糖耐量受损[88]。因此,氯氮平的疗效与不良反应监测应贯穿整个剂量滴定阶段。
氯氮平相关的粒细胞缺乏症(即中性粒细胞绝对值<0.5×109/L)是一种严重且可能危及生命的不良反应[88]。一项包含了108项研究的meta分析显示,在氯氮平使用的前18周内累计轻度粒细胞减少(≤1.5×109/L)的发生率为3.8%,中度粒细胞下降(≤1.0×109/L)为1.3%,而粒细胞缺乏症发生率为0.9%(若仅考虑高质量文献证据时为0.7%),在西方不同国家结果基本一致[89](证据等级2a)。相较于欧美国家0.7%左右的氯氮平相关粒细胞缺乏症发生率,我国研究发现氯氮平所致粒细胞缺乏症在中国的发生率仅0.21%[90]。粒细胞缺乏可发生在氯氮平治疗的任何时候,在初始治疗阶段更为常见,上述meta分析提示,约38%发生在4周内,56%在8周内,84%在18周内,89%发生在第1年内[89](证据等级2a)。2项分别来自澳大利亚/新西兰与芬兰的大型观察性队列发现,氯氮平所致粒细胞缺乏症发生率在首次使用氯氮平的前18周最高,随后逐渐降低,24个月后可忽略不计[91-92](证据等级3b)。
基于上述证据,西方各国建立了氯氮平使用过程中外周血白细胞及中性粒细胞减少的预警系统,但严格的血液学检查并未使氯氮平相关的粒细胞下降风险降低,反而限制了氯氮平的使用。2025年欧洲氯氮平工作组专家共识建议,应当优化氯氮平相关的白细胞与中性粒细胞绝对值的监测策略[93](证据等级5b)。本次专家组认可欧洲氯氮平工作组最新研究结果,明确几个复查血常规的时间点,具体如本条推荐意见所述。
氯氮平相关粒细胞下降经过锂剂或粒细胞集落刺激因子等治疗康复后,是否可以重新使用氯氮平,目前尚有争议。MIJOVIC等[94]的系统综述发现,约79%的粒细胞下降患者使用粒细胞集落刺激因子治疗后可重新使用氯氮平治疗,但粒细胞缺乏患者重新使用失败率高达80%(证据等级3a)。
临床问题5 CRS的治疗方案
推荐意见12 ①氯氮平联合电休克治疗(electroconvulsive therapy,ECT)(专家共识度97%,证据等级1a~4c);②ECT治疗有效患者可以考虑联合ECT维持治疗(专家共识度97%,证据等级1d~2d)。
TRS患者中,约40%~70%对足量足疗程的氯氮平治疗无反应,即超难治性精神分裂症(或CRS)患者,诊断标准见“推荐意见7”。CRS患者的临床诊疗往往给精神科医生带来巨大挑战,目前尚无统一的治疗方案及流程。因此提供可供临床医生参考的联合治疗方案十分有必要。
一项meta分析发现,TRS患者采用ECT联合氯氮平治疗有效率约为54%~66%,平均ECT治疗次数为11.3次,其中RCT研究提示联合治疗有效率优于单用氯氮平或单用ECT治疗(71% vs. 46% vs. 40%)[95](证据等级1b)。多项meta分析同样发现,TRS患者ECT联合治疗对比标准药物治疗有效率更高[96-99],并且可以预防复发及提高出院率[96-97](证据等级1a)。一项较新的前瞻性非随机对照研究纳入符合TRRIP工作组定义的CRS患者,发现氯氮平联合ECT治疗可以有效改善患者8周临床总体印象量表(clinical global impression scale,CGI)及PANSS评分[100](证据等级2c),可作为氯氮平无效时的增效策略。治疗次数及响应速度证据来自CHAN等[101]的回顾性队列,该研究中TRS患者接受ECT联合常规药物治疗,第3、6、9、12次治疗后治疗有效率分别为16.7%、39.3%、46.4%和50%,第3次和第6次ECT治疗之间有效率差异最明显(证据等级4c)。
多项研究报道了TRS患者在急性期ECT治疗后继续采用ECT维持治疗的有效性,但对于ECT的治疗频次和持续时间尚未有统一的共识[102-104]。2022年的一项开放标签RCT研究显示,TRS患者在原有氯氮平治疗基础上采用为期6个月的ECT联合治疗方案(第1个月的最初1~2周给予6次急性期ECT治疗,随后给予ECT维持治疗,第3~4周每周1次,第2~3个月每两周1次,第4~6个月每月1次),该方案被证实能在短期内有效减轻TRS患者的PANSS及CGI得分,并改善整体功能[功能大体评定量表(global assessment of function,GAF)]及认知功能[蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)][102](证据等级1d)。2项回顾性队列研究发现,氯氮平联合ECT维持治疗有助于患者症状的持续缓解,降低年均住院时长,并改善社会功能及生活质量[103-104](证据等级2d),其中YOUN等[104]ECT方案为急性期每周2~3次,逐渐减少至每周1次,获得症状的改善后继续采用维持ECT增效治疗6个月至2年。
推荐意见13 针对CRS患者,临床上抗精神病药物联合治疗比较常见,可以考虑两种抗精神病药物联合治疗。(专家共识度96%,证据等级1a~4a)
推荐意见14 基于氯氮平的联合治疗方案:①氯氮平+氨磺必利联合治疗方案(专家共识度90%,证据等级1b~1c);②氯氮平+阿立哌唑联合治疗方案(专家共识度90%,证据等级1a~2d);③氯氮平+抗精神病药物长效针剂(专家共识度87%,证据等级2d); ④氯氮平+丙戊酸盐联合治疗方案(专家共识度73%,证据等级1a~2b)。
CRS患者抗精神病药物联合治疗,通常方案为在氯氮平基础上增加另外一种药物。本共识第一轮调研中,将基于氯氮平的联合治疗方案分为抗精神病药物联合治疗方案(包含氨磺必利、阿立哌唑、利培酮/帕利哌酮、氟哌啶醇、抗精神病药物长效针剂)、氯氮平联合心境稳定剂治疗方案(拉莫三嗪、丙戊酸盐)以及氯氮平联合抗抑郁药治疗方案(氟西汀、氟伏沙明),最终上述推荐意见14的四种联合治疗方案达成共识。此外,氯氮平+利哌酮/帕利哌酮亦达成共识,但由于循证证据缺乏,经过指导委员会及专家组讨论,未纳入最终推荐意见。
部分专家建议,应限定CRS患者抗精神病药物联合治疗的药物数量,故在第二轮调研过程中补充设置了推荐意见13,表述为“针对CRS患者,抗精神病药物联合治疗的种类限制(两种、三种、三种以上)”,其中两种抗精神病药物联合用药达成共识,而三种及三种以上抗精神病药物联用均未达成共识。一项综述显示,两种抗精神病药物联用在精神分裂症患者治疗方案中占比约为17.8%~44.1%,而三种及以上约为0.2%~22.4%[105](证据等级4a)。目前关于两种抗精神病药物联用有效性的证据不统一。一项meta分析总结发现精神分裂症谱系障碍患者抗精神病药物联合用药比例高达33.2%,且在过去50年内逐步上升,联合用药与更高的疾病严重程度及全因死亡率相关,但并未逆转上述结局,且不良反应更多[20](证据等级4a)。GROVER等[98]的meta分析针对CRS患者,发现联合用药对比单药治疗效果更佳(证据等级1a)。相反,一项2024年发表的meta分析纳入10项RCT,发现对于基线症状严重的患者,两种抗精神病药物联用相比单药治疗在减轻症状方面更能获益,但氯氮平联合第一代抗精神病药或第二代抗精神病药均无显著获益,优势主要体现在两种第二代抗精神病药联用时[106](证据等级1a)。因此,抗精神病药物联合治疗仍需更多研究探索。
具体方案方面,2022年一项小样本的RCT研究发现,在氯氮平的基础上联合氨磺必利(400~800 mg/d),CRS患者PANSS评分获得显著改善(阴性症状评分除外)[107](证据等级1c),但既往系统综述发现CRS患者氯氮平联合氨磺必利治疗,症状改善程度与氯氮平单药治疗无明显差异,且联合治疗组不良反应更多[108](证据等级1b)。氯氮平+阿立哌唑联合方案证据来自2项meta分析,相比氯氮平单药治疗,其对CRS患者具有优势[98, 109](证据等级1a),而另一项meta分析则发现氯氮平+阿立哌唑的优势主要体现在对阴性症状的改善[21](证据等级1a)。2019年芬兰全国队列研究显示,氯氮平联用阿立哌唑方案组精神科再住院风险较氯氮平单药治疗组降低14%~23%,是唯一相较氯氮平单药治疗更有优势的方案[22](证据等级3c)。同时有RCT研究发现阿立哌唑增效治疗可以改善与氯氮平相关的体重增加或其他相关代谢问题[110](证据等级1c)。TIEN等[111]一项回顾性队列显示,TRS患者氯氮平与长效针剂联合治疗依从性更高,且平均再住院风险显著降低(证据等级2d)。ZHENG等[112]meta分析发现氯氮平联合丙戊酸钠或拉莫三嗪相较于单用氯氮平在改善PANSS或简明精神病量表(brief psychiatric rating scale,BPRS)得分上均更有优势,但在剔除2项低质量研究后,仅联合丙戊酸钠仍有优势(证据等级1a)。2009年一项研究发现氯氮平联合丙戊酸治疗可以改善TRS患者的阳性症状、一般病理性症状以及整体症状[113]。这一结果同样被2018年发表的meta分析支持[109](证据等级2b)。
第一轮调研中,氯氮平联合利培酮/帕利哌酮的治疗方案达成共识(共识度90%)。然而,仅一篇RCT研究显示氯氮平联合利培酮(6 mg/d)可改善TRS患者症状,且耐受性好,但该研究的干预组与对照组的氯氮平平均剂量存在显著差异,且样本量偏小,因此在结论的推广上需要谨慎[114](证据等级1d)。几项重要的meta分析中,氯氮平联合利培酮相比氯氮平单药并未显示出疗效优势[98-99, 109]。芬兰的观察性研究发现,除氯氮平+阿立哌唑外,其余氯氮平+抗精神病药物口服药联用方案在降低再住院风险上均不优于单用氯氮平[22]。目前尚无氯氮平+口服帕利哌酮治疗方案相关的研究。因此,经过专家组及指导委员会的慎重考虑,氯氮平+利培酮/帕利哌酮联合治疗方案最终未纳入推荐意见。此外,CRS患者使用氯氮平增效治疗的meta分析提示,米氮平、美金刚、氟西汀等也可能有助于患者总体及不同维度症状改善[99, 109](证据等级1b),少量RCT及队列研究提示齐拉西酮、鲁拉西酮也可能使CRS患者症状改善[115-116],但总体证据不足。
临床问题6 氯氮平不能耐受患者治疗方案
推荐意见15 在书面知情同意并严密监测药物不良反应情况下,可尝试大剂量抗精神病药物,如奥氮平(≤30 mg/d)治疗。(专家共识度70%,证据等级1a)
推荐意见16 针对氯氮平不能耐受的难治性患者,可尝试奥氮平与氨磺必利联合治疗方案。(专家共识度97%,证据等级2c)
针对氯氮平不能耐受的TRS患者,目前认为可尝试的方案包括单一抗精神病药物大剂量治疗,以及其他抗精神病药物联合用药。通常在联合用药前先采用单一用药方案。
GANNON等[117]的系统综述纳入了6项RCT和4项开放标签研究,发现大剂量奥氮平(大于目前说明书最大剂量20 mg/d)在多数研究中对TRS患者的疗效和耐受性与氯氮平相当,少数研究中疗效或耐受性劣于氯氮平,因此专家组认为大剂量奥氮平是氯氮平不能耐受时合适的治疗选择,但氯氮平可以耐受时不应作为首选(证据等级1a)。一项中国人群RCT研究显示大剂量奥氮平(≤30 mg/d)可以改善部分TRS患者的精神病性症状,且耐受性佳[118](证据等级1c),但该研究纳入了部分不能耐受其他抗精神病药物不良反应的精神分裂症患者(约30%),研究对象并非严格的TRS患者。目前关于其他抗精神病药物超剂量使用的疗效证据尚不统一,且存在较高安全性风险,因此总体上持谨慎态度。SAMARA等[119]的一项包含10项RCT研究的系统综述显示,没有足够证据表明在足量抗精神病药物治疗效果欠佳时增加剂量会提高疗效,该系统综述纳入氟哌啶醇、喹硫平、奥氮平、齐拉西酮、鲁拉西酮、奋乃静、氨砜噻吨相关研究,其中奥氮平剂量偏低(最高20 mg/d),并未达到严格意义上的大剂量标准(证据等级1a)。MIRANDA等[120]一项为期6年的回顾性镜像研究显示,高剂量第二代抗精神病药物长效针剂(利培酮、帕利哌酮、阿立哌唑)可改善TRS患者总体症状和治疗依从性,降低住院次数、自杀倾向以及残疾率,并具有良好的耐受性(证据等级2d),尚无更高级别证据。基于证据及实际临床需要,当氯氮平存在禁忌时,大剂量奥氮平可作为一个选择。需要特别注意,在超说明书使用药物时,需要对患者及家属进行充分的书面知情告知,确保其充分理解潜在的不良反应,并进行严密监测,一旦评估其疗效欠佳或有严重的不良反应,需及时评估获益与风险,调整剂量或换用其他治疗方案。未来仍需要更多的高质量研究探索抗精神病药物超说明书使用的疗效及安全性。
除氯氮平外的抗精神病药物联合治疗总体证据匮乏。我国一项对照研究发现,氨磺必利联合奥氮平的组合疗效优于单用氨磺必利的疗效(改善临床症状、降低焦虑水平、改善认知功能、改善神经递质水平)且不会明显增加不良反应[121](证据等级3d),可作为氯氮平不能耐受时的后备治疗方案。在第一轮调研中,奥氮平联合利培酮治疗CRS亦达成了共识(专家共识度93%)。然而,仅一项小型观察性研究提示奥氮平联合利培酮可使部分TRS患者获益,同时会面临更多的药物不良反应[122](证据等级3c);另外一项病例系列报告(n=5)发现奥氮平联合利培酮治疗CRS可降低患者的BPRS得分(证据等级4c)。鉴于缺乏高质量的研究,经过专家组及指导委员会的慎重考虑,最终未形成推荐意见。
临床问题7 心理社会干预在TRS患者中应用
推荐意见17 TRS患者可在药物治疗基础上联用针对精神病性症状的认知行为治疗(cognitive behavior therapy for psychosis,CBTp)进行干预。(专家共识度90%,证据等级1a)
POLESE等[123]的系统综述汇总近25年来的研究,提示CBTp治疗可改善患者6个月及12个月的阳性症状,尤其是幻听方面,但对阴性症状的改善效果不明显,且随着时间的推移,其效果逐渐减退(证据等级1a)。TODOROVIC等[124]的系统综述和meta分析显示,CBTp可改善CRS患者的阳性症状,且在6~12个月的随访时点仍能观察到改善的效应(证据等级1a)。2021年的一项系统综述发现在降低12个月的复发率方面,家庭干预(15%)、复发预防计划(15%)、CBTp(20%)、家庭心理教育(23%)以及综合干预(25%)均优于常规治疗(35%)[125](证据等级1a)。考虑到CBTp相关研究的可重复性、证据的一致性较高,目前推荐其作为TRS心理社会干预的一线选择。
3 总结与展望
本共识围绕TRS的相关临床问题展开,涵盖了危险因素及预防、诊断及评估、氯氮平治疗方案、不良反应处理、氯氮平抵抗及不能耐受时的治疗方案以及心理社会干预等多个方面,对国内各级医疗机构(尤其基层医院)的精神科临床实践具有指导作用和参考价值。目前,部分临床问题(如抗精神病药物联合用药的可行方案及临床获益)尚存在较大争议,循证证据不充分或严重不足,期待未来出现更多围绕这些问题开展的高质量临床研究。本共识尚存在一些不足之处,如:专家组缺乏多学科团队参与,为确保调研匿名性无法基于地域或其他专家特征进行分析;此外,TRS自身存在异质性,例如原发性或继发性TRS等,近年研究认为其可能具有不同的发病机制,本共识未能形成更具有针对性和可操作性的临床决策推荐;同时,本共识未包含以阴性症状或认知症状为主的TRS。本共识将在未来持续更新,以期更好地服务于临床需求。
指导委员会:江开达(上海交通大学医学院附属精神卫生中心),赵靖平(中南大学湘雅二医院),于欣(北京大学第六医院),司天梅(北京大学第六医院),李春波(上海交通大学医学院附属精神卫生中心)
专家组成员(以姓氏汉语拼音字母排序):陈喆烨(香港大学),程宇琪(杭州市第七人民医院),丛伟东(福建省福州神经精神病防治院),董芳(首都医科大学附属北京安定医院),郭万军(杭州市第七人民医院),郭文斌(中南大学湘雅二医院),黄满丽(浙江大学医学院附属第一医院),李冠军(上海交通大学医学院附属精神卫生中心),李清伟(上海市精神卫生中心),刘哲宁(中南大学湘雅二医院),刘志芬(山西医科大学第一医院),陆小兵(广州医科大学附属脑科医院),马现仓(西安交通大学第一附属医院),蒲城城(北京大学第六医院),邱昌建(四川大学华西医院),石川(北京大学第六医院),宋学勤(郑州大学第一附属医院),隋毓秀(南京医科大学附属脑科医院),谭云龙(北京回龙观医院),汤文杰(慈溪市第七人民医院),王传跃(首都医科大学附属北京安定医院),王化宁(空军军医大学西京医院),王惠玲(武汉大学人民医院),王继军(上海交通大学医学院附属精神卫生中心),吴仁容(中南大学湘雅二医院),吴小立(中山大学附属第三医院),夏炎(哈尔滨医科大学附属第一医院),杨甫德(北京回龙观医院),翟金国(山东省戴庄医院),朱刚(中国医科大学附属第一医院)
工作组/执笔组成员:马相宜(上海交通大学医学院附属精神卫生中心),张秀(广州医科大学附属脑科医院),薛菁心(上海交通大学医学院附属精神卫生中心),亢清(上海交通大学医学院附属精神卫生中心),龙翔云(广州医科大学附属脑科医院),唐培源(上海交通大学医学院附属精神卫生中心),韦思嘉(上海交通大学医学院附属精神卫生中心),刘佳琪(广州医科大学附属脑科医院),佘生林(广州医科大学附属脑科医院),郑英君(广州医科大学附属脑科医院),刘登堂(上海交通大学医学院附属精神卫生中心)
参考文献:
1. KANE J, HONIGFELD G, SINGER J, et al. Clozapine for the treatment-resistant schizophrenic. A double-blind comparison with chlorpromazine[J]. Arch Gen Psychiatry, 1988, 45(9): 789-796.
2. DINIZ E, FONSECA L, ROCHA D, et al. Treatment resistance in schizophrenia: A meta-analysis of prevalence and correlates[J]. Braz J Psychiatry, 2023, 45(5): 448-458.
3. SISKIND D, MCCARTNEY L, GOLDSCHLAGER R, et al. Clozapine v. first- and second-generation antipsychotics in treatment-refractory schizophrenia: Systematic review and meta-analysis[J]. Br J Psychiatry, 2016, 209(5): 385-392.
4. TIIHONEN J, MITTENDORFER-RUTZ E, MAJAK M, et al. Real-world effectiveness of antipsychotic treatments in a nationwide cohort of 29823 patients with schizophrenia[J]. JAMA Psychiatry, 2017, 74(7): 686-693.
5. SISKIND D, SISKIND V, KISELY S. Clozapine response rates among people with treatment-resistant schizophrenia: Data from a systematic review and meta-analysis[J]. Can J Psychiatry, 2017, 62(11): 772-777.
6. ELKIS H, BUCKLEY P F. Treatment-resistant schizophrenia[J]. Psychiatr Clin North Am, 2016, 39(2): 239-265.
7. KENNEDY J L, ALTAR C A, TAYLOR D L, et al. The social and economic burden of treatment-resistant schizophrenia: A systematic literature review[J]. Int Clin Psychopharmacol, 2014, 29(2): 63-76.
8. 王春青, 胡雁. JBI证据预分级及证据推荐级别系统(2014版)[J]. 护士进修杂志, 2015, 11: 964‐967.
9. SMART S E, KEPINSKA A P, MURRAY R M, et al. Predictors of treatment resistant schizophrenia: A systematic review of prospective observational studies[J]. Psychol Med, 2021, 51(1): 44-53.
10. BOZZATELLO P, BELLINO S, ROCCA P. Predictive factors of treatment resistance in first episode of psychosis: A systematic review[J]. Front Psychiatry, 2019, 10: 67.
11. CHAN S K W, CHAN H Y V, HONER W G, et al. Predictors of treatment-resistant and clozapine-resistant schizophrenia: A 12-year follow-up study of first-episode schizophrenia-spectrum disorders[J]. Schizophr Bull, 2021, 47(2): 485-494.
12. LEUCHT S, CRIPPA A, SIAFIS S, et al. Dose-response meta-analysis of antipsychotic drugs for acute schizophrenia[J]. Am J Psychiatry, 2020, 177(4): 342-353.
13. HUI C L M, LAM B S T, LEE E H M, et al. A systematic review of clinical guidelines on choice, dose, and duration of antipsychotics treatment in first- and multi-episode schizophrenia[J]. Int Rev Psychiatry, 2019, 31(5-6): 441-459.
14. CERASO A, LIN J J, SCHNEIDER-THOMA J, et al. Maintenance treatment with antipsychotic drugs for schizophrenia[J]. Cochrane Database Syst Rev, 2020, 8(8): CD008016.
15. OSTUZZI G, VITA G, BERTOLINI F, et al. Continuing, reducing, switching, or stopping antipsychotics in individuals with schizophrenia-spectrum disorders who are clinically stable: A systematic review and network meta-analysis[J]. Lancet Psychiatry, 2022, 9(8): 614-624.
16. LEUCHT S, BAUER S, SIAFIS S, et al. Examination of dosing of antipsychotic drugs for relapse prevention in patients with stable schizophrenia: A meta-analysis[J]. JAMA Psychiatry, 2021, 78(11): 1238-1248.
17. KISHI T, IKUTA T, MATSUI Y, et al. Effect of discontinuation v. maintenance of antipsychotic medication on relapse rates in patients with remitted/stable first-episode psychosis: A meta-analysis[J]. Psychol Med, 2019, 49(5): 772-779.
18. RODOLICO A, SIAFIS S, BIGHELLI I, et al. Antipsychotic dose reduction compared to dose continuation for people with schizophrenia[J]. Cochrane Database Syst Rev, 2022, 11(11): CD014384.
19. HOJLUND M, KEMP A F, HADDAD P M, et al. Standard versus reduced dose of antipsychotics for relapse prevention in multi-episode schizophrenia: A systematic review and meta-analysis of randomised controlled trials[J]. Lancet Psychiatry, 2021, 8(6): 471-486.
20. HOJLUND M, KOHLER-FORSBERG O, GREGERSEN A T, et al. Prevalence, correlates, tolerability-related outcomes, and efficacy-related outcomes of antipsychotic polypharmacy: A systematic review and meta-analysis[J]. Lancet Psychiatry, 2024, 11(12): 975-989.
21. GALLING B, ROLDAN A, HAGI K, et al. Antipsychotic augmentation vs. monotherapy in schizophrenia: Systematic review, meta-analysis and meta-regression analysis[J]. World Psychiatry, 2017, 16(1): 77-89.
22. TIIHONEN J, TAIPALE H, MEHTALA J, et al. Association of antipsychotic polypharmacy vs monotherapy with psychiatric rehospitalization among adults with schizophrenia[J]. JAMA Psychiatry, 2019, 76(5): 499-507.
23. NYANYIWA S, PETERS K, MURPHY G. A scoping review: Treatment attitudes and adherence for adults with schizophrenia[J]. J Clin Nurs, 2022, 31(21-22): 3060-3075.
24. WADE M, TAI S, AWENAT Y, et al. A systematic review of service-user reasons for adherence and nonadherence to neuroleptic medication in psychosis[J]. Clin Psychol Rev, 2017, 51: 75-95.
25. SENDT KV, TRACY DK, BHATTACHARYYA S. A systematic review of factors influencing adherence to antipsychotic medication in schizophrenia-spectrum disorders[J]. Psychiatry Res, 2015, 225(1-2): 14-30.
26. SKIKIC M, ARRIOLA J A. First episode psychosis medical workup: Evidence-informed recommendations and introduction to a clinically guided approach[J]. Child Adolesc Psychiatr Clin N Am, 2020, 29(1): 15-28.
27. DISSAUX N, NEYME P, KIM-DUFOR D H, et al. Psychosis caused by a somatic condition: How to make the diagnosis? A systematic literature review[J]. Children (Basel), 2023, 10(9): 1439.
28. RASMUSSEN A R, PARNAS J. What is obsession? Differentiating obsessive-compulsive disorder and the schizophrenia spectrum[J]. Schizophr Res, 2022, 243: 1-8.
29. POLLAK T A, LENNOX B R, MULLER S, et al. Autoimmune psychosis: an international consensus on an approach to the diagnosis and management of psychosis of suspected autoimmune origin[J]. Lancet Psychiatry, 2020, 7(1): 93-108.
30. ENDRES D, LEYPOLDT F, BECHTER K, et al. Autoimmune encephalitis as a differential diagnosis of schizophreniform psychosis: Clinical symptomatology, pathophysiology, diagnostic approach, and therapeutic considerations[J]. Eur Arch Psychiatry Clin Neurosci, 2020, 270(7): 803-818.
31. STEINER J, PRUSS H, KOHLER S, et al. Autoimmune encephalitis with psychosis: Warning signs, step-by-step diagnostics and treatment[J]. World J Biol Psychiatry, 2020, 21(4): 241-254.
32. DING JB, DONGAS J, HU K, et al. Autoimmune limbic encephalitis: A review of clinicoradiological features and the challenges of diagnosis[J]. Cureus, 2021, 13(8): e17529.
33. POLLAK T A, MCCORMACK R, PEAKMAN M, et al. Prevalence of anti-N-methyl-D-aspartate (NMDA) receptor [corrected] antibodies in patients with schizophrenia and related psychoses: A systematic review and meta-analysis[J]. Psychol Med, 2014, 44(12): 2475-2487.
34. SABE M, SENTISSI O. Psychotic symptoms prior or concomitant to diagnosis of multiple sclerosis: A systematic review of case reports and case series[J]. Int J Psychiatry Clin Pract, 2022, 26(3): 287-293.
35. LAM M, HILL W D, TRAMPUSH J W, et al. Pleiotropic meta-analysis of cognition, education, and schizophrenia differentiates roles of early neurodevelopmental and adult synaptic pathways[J]. Am J Hum Genet, 2019, 105(2): 334-350.
36. DI LUZIO M, PONTILLO M, VILLA M, et al. Clinical features and comorbidity in very early-onset schizophrenia: A systematic review[J]. Front Psychiatry, 2023, 14: 1270799.
37. NEWTON-HOWES G, TYRER P, NORTH B, et al. The prevalence of personality disorder in schizophrenia and psychotic disorders: Systematic review of rates and explanatory modelling[J]. Psychol Med, 2008, 38(8): 1075-1082.
38. HUNT G E, LARGE M M, CLEARY M, et al. Prevalence of comorbid substance use in schizophrenia spectrum disorders in community and clinical settings, 1990-2017: Systematic review and meta-analysis[J]. Drug Alcohol Depend, 2018, 191: 234-258.
39. CORRELL C U, SOLMI M, CROATTO G, et al. Mortality in people with schizophrenia: A systematic review and meta-analysis of relative risk and aggravating or attenuating factors[J]. World Psychiatry, 2022, 21(2): 248-271.
40. KERFOOT K E, ROSENHECK R A, PETRAKIS I L, et al. Substance use and schizophrenia: adverse correlates in the CATIE study sample[J]. Schizophr Res, 2011, 132(2-3): 177-182.
41. GARDNER D M, MURPHY A L, O’DONNELL H, et al. International consensus study of antipsychotic dosing[J]. Am J Psychiatry, 2010, 167(6): 686-693.
42. AGID O, KAPUR S, ARENOVICH T, et al. Delayed-onset hypothesis of antipsychotic action: A hypothesis tested and rejected[J]. Arch Gen Psychiatry, 2003, 60(12): 1228-1235.
43. SHERWOOD M, THORNTON A E, HONER W G. A meta-analysis of profile and time-course of symptom change in acute schizophrenia treated with atypical antipsychotics[J]. Int J Neuropsychopharmacol, 2006, 9(3): 357-366.
44. EMSLEY R, RABINOWITZ J, MEDORI R. Time course for antipsychotic treatment response in first-episode schizophrenia[J]. Am J Psychiatry, 2006, 163(4): 743-745.
45. GRIFFITHS K, MILLGATE E, EGERTON A, et al. Demographic and clinical variables associated with response to clozapine in schizophrenia: A systematic review and meta-analysis[J]. Psychol Med, 2021, 51(3): 376-386.
46. YOSHIMURA B, YADA Y, SO R, et al. The critical treatment window of clozapine in treatment-resistant schizophrenia: Secondary analysis of an observational study[J]. Psychiatry Res, 2017, 250: 65-70.
47. LEUCHT S, CIPRIANI A, SPINELI L, et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: A multiple-treatments meta-analysis[J]. Lancet, 2013, 382(9896): 951-962.
48. HUHN M, NIKOLAKOPOULOU A, SCHNEIDER-THOMA J, et al. Comparative efficacy and tolerability of 32 oral antipsychotics for the acute treatment of adults with multi-episode schizophrenia: A systematic review and network meta-analysis[J]. Lancet, 2019, 394(10202): 939-951.
49. CZOBOR P, VAN DORN R A, CITROME L, et al. Treatment adherence in schizophrenia: A patient-level meta-analysis of combined CATIE and EUFEST studies[J]. Eur Neuropsychopharmacol, 2015, 25(8): 1158-1166.
50. YAEGASHI H, KIRINO S, REMINGTON G, et al. Adherence to oral antipsychotics measured by electronic adherence monitoring in schizophrenia: A systematic review and meta-analysis[J]. CNS Drugs, 2020, 34(6): 579-598.
51. VELLIGAN D I, WANG M, DIAMOND P, et al. Relationships among subjective and objective measures of adherence to oral antipsychotic medications[J]. Psychiatr Serv, 2007, 58(9): 1187-1192.
52. KENNEDY W K, JANN M W, KUTSCHER E C. Clinically significant drug interactions with atypical antipsychotics[J]. CNS Drugs, 2013, 27(12): 1021-1048.
53. XIONG G, YANG Z, YI J, et al. DDInter: An online drug-drug interaction database towards improving clinical decision-making and patient safety[J]. Nucleic Acids Res, 2022, 50(D1): D1200-D1207.
54. RAVYN D, RAVYN V, LOWNEY R, et al. CYP450 pharmacogenetic treatment strategies for antipsychotics: A review of the evidence[J]. Schizophr Res, 2013, 149(1-3): 1-14.
55. LALLY J, GAUGHRAN F, TIMMS P, et al. Treatment-resistant schizophrenia: Current insights on the pharmacogenomics of antipsychotics[J]. Pharmgenomics Pers Med, 2016, 9: 117-129.
56. TSUDA Y, SARUWATARI J, YASUI-FURUKORI N. Meta-analysis: The effects of smoking on the disposition of two commonly used antipsychotic agents, olanzapine and clozapine[J]. BMJ Open, 2014, 4(3): e004216.
57. GREENBERG W M, CITROME L. Pharmacokinetics and pharmacodynamics of lurasidone hydrochloride, a second-generation antipsychotic: A systematic review of the published literature[J]. Clin Pharmacokinet, 2017, 56(5): 493-503.
58. CITROME L. Using oral ziprasidone effectively: The food effect and dose-response[J]. Adv Ther, 2009, 26(8): 739-748.
59. OKOLI C T C, KAPPI A, WANG T, et al. The effect of long-acting injectable antipsychotic medications compared with oral antipsychotic medications among people with schizophrenia: A systematic review and meta-analysis[J]. Int J Ment Health Nurs, 2022, 31(3): 469-535.
60. HOWES O D, MCCUTCHEON R, AGID O, et al. Treatment-resistant schizophrenia: Treatment Response and Resistance in Psychosis (TRRIP) Working Group Consensus guidelines on diagnosis and terminology[J]. Am J Psychiatry, 2017, 174(3): 216-229.
61. 第3版《中国精神分裂症防治指南》编写组. 第3版《中国精神分裂症防治指南》计划书[J]. 中华精神科杂志, 2023, 56(5): 331-335.
62. SCHULTE P. What is an adequate trial with clozapine?: Therapeutic drug monitoring and time to response in treatment-refractory schizophrenia[J]. Clin Pharmacokinet, 2003, 42(7): 607-618.
63. LEUCHT S, KOMOSSA K, RUMMEL-KLUGE C, et al. A meta-analysis of head-to-head comparisons of second-generation antipsychotics in the treatment of schizophrenia[J]. Am J Psychiatry, 2009, 166(2): 152-163.
64. Japanese Society of Neuropsychopharmacology. Japanese Society of Neuropsychopharmacology: “Guideline for Pharmacological Therapy of Schizophrenia”[J]. Neuropsychopharmacol Rep, 2021, 41(3): 266-324.
65. DGPPN e.V. (ed.) for the Guideline Group: S3 Guideline for Schizophrenia. Abbreviated version (English), 2019, Version 1.0 [EB/OL].(2019-12-29) [2025-04-27]. https://www.awmf.org/leitlinien/detail/ll/038-009.html.
66. American Psychiatric Association. The American Psychiatric Association Practice Guideline for the Treatment of Patients with Schizophrenia[M]. 3rd Ed. Arlington, VA: American Psychiatric Association, 2021.
67. GALLETLY C, CASTLE D, DARK F, et al. Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for the management of schizophrenia and related disorders[J]. Aust N Z J Psychiatry, 2016, 50(5): 410-472.
68. BARNES T R, DRAKE R, PATON C, et al. Evidence-based guidelines for the pharmacological treatment of schizophrenia: Updated recommendations from the British Association for Psychopharmacology[J]. J Psychopharmacol, 2020, 34(1): 3-78.
69. HASAN A, FALKAI P, WOBROCK T, et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of schizophrenia - a short version for primary care[J]. Int J Psychiatry Clin Pract, 2017, 21(2): 82-90.
70. TAKEUCHI H, POWELL V, GEISLER S, et al. Clozapine administration in clinical practice: Once-daily versus divided dosing[J]. Acta Psychiatr Scand, 2016, 134(3): 234-240.
71. MASUDA T, MISAWA F, TAKASE M, et al. Association with hospitalization and all-cause discontinuation among patients with schizophrenia on clozapine vs other oral second-generation antipsychotics: A systematic review and meta-analysis of cohort studies[J]. JAMA Psychiatry, 2019, 76(10): 1052-1062.
72. LAND R, SISKIND D, MCARDLE P, et al. The impact of clozapine on hospital use: A systematic review and meta-analysis[J]. Acta Psychiatr Scand, 2017, 135(4): 296-309.
73. VERMEULEN J M, VAN ROOIJEN G, VAN DE KERKHOF M P J, et al. Clozapine and long-term mortality risk in patients with schizophrenia: A systematic review and meta-analysis of studies lasting 1.1-12.5 years[J]. Schizophr Bull, 2019, 45(2): 315-329.
74. WIMBERLEY T, MACCABE J H, LAURSEN T M, et al. Mortality and self-harm in association with clozapine in treatment-resistant schizophrenia[J]. Am J Psychiatry, 2017, 174(10): 990-998.
75. HENNEN J, BALDESSARINI R J. Suicidal risk during treatment with clozapine: A meta-analysis[J]. Schizophr Res, 2005, 73(2-3): 139-145.
76. U.S. Food and Drug Administration. VERSACLOZ (Clozapine) NDA 19-758 / S-047 Approval Package [EB/OL]. East Hanover: Novartis Pharmaceuticals Corporation (2002-12-18) [2025-01-16]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2002/019758Orig1s047.pdf.
77. TIIHONEN J, LONNQVIST J, WAHLBECK K, et al. 11-year follow-up of mortality in patients with schizophrenia: A population-based cohort study (FIN11 study)[J]. Lancet, 2009, 374(9690): 620-627.
78. MASDRAKIS V G, BALDWIN D S. Prevention of suicide by clozapine in mental disorders: Systematic review[J]. Eur Neuropsychopharmacol, 2023, 69: 4-23.
79. FROGLEY C, TAYLOR D, DICKENS G, et al. A systematic review of the evidence of clozapine’s anti-aggressive effects[J]. Int J Neuropsychopharmacol, 2012, 15(9): 1351-1371.
80. VICTOROFF J, COBURN K, REEVE A, et al. Pharmacological management of persistent hostility and aggression in persons with schizophrenia spectrum disorders: A systematic review[J]. J Neuropsychiatry Clin Neurosci, 2014, 26(4): 283-312.
81. ANDREEA T, PETRU I, MIRON A A, et al. Clozapine for treatment-refractory aggressive behavior[J]. Psychiatr Q, 2021, 92(2): 721-733.
82. HIEMKE C, BERGEMANN N, CLEMENT H W, et al. Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: Update 2017[J]. Pharmacopsychiatry, 2018, 51(1-2): 9-62.
83. DE LEON J, SCHORETSANITIS G, SMITH R L, et al. An international adult guideline for making clozapine titration safer by using six ancestry-based personalized dosing titrations, crp, and clozapine levels[J]. Pharmacopsychiatry, 2022, 55(2): 73-86.
84. SUZUKI T, REMINGTON G, ARENOVICH T, et al. Time course of improvement with antipsychotic medication in treatment-resistant schizophrenia[J]. Br J Psychiatry, 2011, 199(4): 275-280.
85. SHERWOOD M, THORNTON A E, HONER W G. A quantitative review of the profile and time course of symptom change in schizophrenia treated with clozapine[J]. J Psychopharmacol, 2012, 26(9): 1175-1184.
86. SANAHAN R, SREERAJ V S, SUHAS S, et al. Response to clozapine and its predictors in treatment-resistant schizophrenia spectrum disorders: A retrospective chart review[J]. Schizophr Res, 2025, 275: 179-188.
87. TAYLOR D M, BARNES T R E, YOUNG A H. The Maudsley® Prescribing Guidelines in Psychiatry [M]. UK: WILEY Blackwell, 2021.
88. US Food and Drug Administration. CLOZARIL (Clozapine) product monograph[Z]. Etobicoke: HLS Therapeurics lnc, 2021.
89. MYLES N, MYLES H, XIA S, et al. Meta-analysis examining the epidemiology of clozapine-associated neutropenia[J]. Acta Psychiatr Scand, 2018, 138(2): 101-109.
90. TANG Y L, MAO P X, JIANG F, et al. Clozapine in China[J]. Pharmacopsychiatry, 2008, 41(1): 1-9.
91. NORTHWOOD K, MYLES N, CLARK S R, et al. Evaluating the epidemiology of clozapine-associated neutropenia among people on clozapine across Australia and Aotearoa New Zealand: A retrospective cohort study[J]. Lancet Psychiatry, 2024, 11(1): 27-35.
92. RUBIO J M, KANE J M, TANSKANEN A, et al. Long-term persistence of the risk of agranulocytosis with clozapine compared with other antipsychotics: A nationwide cohort and case-control study in Finland[J]. Lancet Psychiatry, 2024, 11(6): 443-450.
93. VERDOUX H, BITTNER R A, HASAN A, et al. The time has come for revising the rules of clozapine blood monitoring in Europe. A joint expert statement from the European Clozapine Task Force[J]. Eur Psychiatry, 2025, 68(1): e17.
94. MIJOVIC A, MACCABE J H. Clozapine-induced agranulocytosis[J]. Ann Hematol, 2020, 99(11): 2477-2482.
95. LALLY J, TULLY J, ROBERTSON D, et al. Augmentation of clozapine with electroconvulsive therapy in treatment resistant schizophrenia: A systematic review and meta-analysis[J]. Schizophr Res, 2016, 171(1-3): 215-224.
96. SINCLAIR D J, ZHAO S, QI F, et al. Electroconvulsive therapy for treatment-resistant schizophrenia[J]. Cochrane Database Syst Rev, 2019, 3(3): CD011847.
97. THARYAN P, ADAMS C E. Electroconvulsive therapy for schizophrenia[J]. Cochrane Database Syst Rev, 2005, (2): CD000076.
98. GROVER S, SARKAR S, SAHOO S. Augmentation strategies for clozapine resistance: A systematic review and meta-analysis[J]. Acta Neuropsychiatr, 2023, 35(2): 65-75.
99. YEH T C, CORRELL C U, YANG F C, et al. Pharmacological and nonpharmacological augmentation treatments for clozapine-resistant schizophrenia: A systematic review and network meta-analysis with normalized entropy assessment[J]. Asian J Psychiatr, 2023, 79: 103375.
100. PEITL V, PULJIC A, SKROBO M, et al. Clozapine in treatment-resistant schizophrenia and its augmentation with electroconvulsive therapy in ultra-treatment-resistant schizophrenia[J]. Biomedicines, 2023, 11(4): 1072.
101. CHAN C Y W, ABDIN E, SEOW E, et al. Clinical effectiveness and speed of response of electroconvulsive therapy in treatment-resistant schizophrenia[J]. Psychiatry Clin Neurosci, 2019, 73(7): 416-422.
102. MISHRA B R, AGRAWAL K, BISWAS T, et al. Comparison of acute followed by maintenance ECT vs clozapine on psychopathology and regional cerebral blood flow in treatment-resistant schizophrenia: A randomized controlled trial[J]. Schizophr Bull, 2022, 48(4): 814-825.
103. LEVY-RUEFF M, GOUREVITCH R, LOO H, et al. Maintenance electroconvulsive therapy: An alternative treatment for refractory schizophrenia and schizoaffective disorders[J]. Psychiatry Res, 2010, 175(3): 280-283.
104. YOUN T, JEONG S H, KIM Y S, et al. Long-term clinical efficacy of maintenance electroconvulsive therapy in patients with treatment-resistant schizophrenia on clozapine[J]. Psychiatry Res, 2019, 273: 759-766.
105. KAMEI H. Polypharmacy management of antipsychotics in patients with schizophrenia[J]. Medicina (Kaunas), 2022, 58(11): 1584.
106. LOCHMANN VAN BENNEKOM MWH, INTHOUT J, GIJSMAN H J, et al. Efficacy and tolerability of antipsychotic polypharmacy for schizophrenia spectrum disorders. A systematic review and meta-analysis of individual patient data[J]. Schizophr Res, 2024, 272: 1-11.
107. ZHU M H, LIU Z J, HU Q Y, et al. Amisulpride augmentation therapy improves cognitive performance and psychopathology in clozapine-resistant treatment-refractory schizophrenia: A 12-week randomized, double-blind, placebo-controlled trial[J]. Mil Med Res, 2022, 9(1): 59.
108. BARNES T R E, LEESON V, PATON C, et al. Amisulpride augmentation of clozapine for treatment-refractory schizophrenia: A double-blind, placebo-controlled trial[J]. Ther Adv Psychopharmacol, 2018, 8(7): 185-197.
109. SISKIND D J, LEE M, RAVINDRAN A, et al. Augmentation strategies for clozapine refractory schizophrenia: A systematic review and meta-analysis[J]. Aust N Z J Psychiatry, 2018, 52(8): 751-767.
110. FLEISCHHACKER W W, HEIKKINEN M E, OLIE J P, et al. Effects of adjunctive treatment with aripiprazole on body weight and clinical efficacy in schizophrenia patients treated with clozapine: A randomized, double-blind, placebo-controlled trial[J]. Int J Neuropsychopharmacol, 2010, 13(8): 1115-1125.
111. TIEN Y, WANG X Y, HUANG S C, et al. Beneficial effects of concomitant long-acting injectable antipsychotics on time to rehospitalization in patients with treatment-resistant schizophrenia receiving clozapine: A retrospective cohort study[J]. J Clin Psychiatry, 2024, 85(2): 23m15071.
112. ZHENG W, XIANG Y T, YANG X H, et al. Clozapine augmentation with antiepileptic drugs for treatment-resistant schizophrenia: A meta-analysis of randomized controlled trials[J]. J Clin Psychiatry, 2017, 78(5): e498-e505.
113. 高红锐, 王艳, 白翠梅, 等. 心境稳定剂在精神分裂症中的应用研究[J]. 中国临床实用医学, 2009, 3(8): 77-78.
114. JOSIASSEN R C, JOSEPH A, KOHEGYI E, et al. Clozapine augmented with risperidone in the treatment of schizophrenia: A randomized, double-blind, placebo-controlled trial[J]. Am J Psychiatry, 2005, 162(1): 130-136.
115. MUSCATELLO M R, PANDOLFO G, MICO U, et al. Augmentation of clozapine with ziprasidone in refractory schizophrenia: A double-blind, placebo-controlled study[J]. J Clin Psychopharmacol, 2014, 34(1): 129-133.
116. SIWEK M, CHROBAK A A, GOROSTOWICZ A, et al. Lurasidone augmentation of clozapine in schizophrenia-retrospective chart review[J]. Brain Sci, 2023, 13(3): 445.
117. GANNON L, REYNOLDS J, MAHON M, et al. High-dose olanzapine in treatment-resistant schizophrenia: A systematic review[J]. Ther Adv Psychopharmacol, 2023, 13: 20451253231168788.
118. WANG D, WEI N, HU F, et al. Paliperidone extended release versus olanzapine in treatment-resistant schizophrenia: A randomized, double-blind, multicenter study[J]. J Clin Psychopharmacol, 2022, 42(4): 383-390.
119. SAMARA MT, KLUPP E, HELFER B, et al. Increasing antipsychotic dose for non response in schizophrenia[J]. Cochrane Database Syst Rev, 2018, 5(5): CD011883.
120. MIRANDA J, NDEZ S, OZ F. High doses of second-generation long-acting antipsychotics in the treatment of patients with severe resistant schizophrenia. A six-year mirror-image study[J]. Psychiatry Clin Psychopharmacol, 2020, 30(4): 1.
121. 穆小梅, 王秀梅, 牛慧明, 等. 奥氮平与氨磺必利联合用药方案治疗难治性精神分裂症的临床价值评价[J]. 中国全科医学, 2019, 22(52): 258-259.
122. SUZUKI T, UCHIDA H, WATANABE K, et al. Effectiveness of antipsychotic polypharmacy for patients with treatment refractory schizophrenia: An open-label trial of olanzapine plus risperidone for those who failed to respond to a sequential treatment with olanzapine, quetiapine and risperidone[J]. Hum Psychopharmacol, 2008, 23(6): 455-463.
123. POLESE D, FORNARO M, PALERMO M, et al. Treatment-resistant to antipsychotics: A resistance to everything? Psychotherapy in treatment-resistant schizophrenia and nonaffective psychosis: A 25-year systematic review and exploratory meta-analysis[J]. Front Psychiatry, 2019, 10: 210.
124. TODOROVIC A, LAL S, DARK F, et al. CBTp for people with treatment refractory schizophrenia on clozapine: A systematic review and meta-analysis[J]. J Ment Health, 2023, 32(1): 321-328.
125. BIGHELLI I, RODOLICO A, GARCIA-MIERES H, et al. Psychosocial and psychological interventions for relapse prevention in schizophrenia: A systematic review and network meta-analysis[J]. Lancet Psychiatry, 2021, 8(11): 969-980.
【引用格式】马相宜,张秀,薛菁心,等.难治性精神分裂症中国专家共识(2025)[J]. 中国神经精神疾病杂志,2025,51(4):193-210.
【Cite this article】MA X Y,ZHANG X,XUE J X,et al.Chinese experts consensus on treatment-resistant schizophrenia (2025)[J]. Chin J Nervous Mental Dis,2024,51(4):193-210.
DOI:10.3969/j.issn.1002-0152.2025.04.001
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#精神分裂症# #氯氮平#
31 举报