Nat Cancer | 小细胞肺癌治疗新曙光:基于类器官研究锁定 IGF-1 关键靶点
2025-05-07 MedSci原创 MedSci原创 发表于陕西省
该研究通过建立全面的SCLC类器官库,揭示了非NE型SCLC对IGF-1的依赖性及其分子机制。研究表明IGF1R在非NE型SCLC中发挥关键作用,并且IGF1R抑制剂可能成为针对这一亚型的有效治疗策略
小细胞肺癌(SCLC)是一种极具侵袭性的肺癌类型,占所有肺癌病例的15%。其特点是生长迅速、早期转移,导致患者5年生存率不足10%。尽管近年来SCLC的分子分型取得了一定进展,被分为四种基于转录因子(TF)的亚型,但针对这些亚型的特异性疗法仍然缺乏。目前的治疗手段,包括化疗和免疫检查点抑制剂,虽然在一定程度上延长了患者的生存期,但总体生存率仍然较低。因此,深入研究SCLC的分子机制,开发针对特定亚型的精准治疗策略,是当前亟待解决的问题。
近日,国际权威期刊Nature Cancer上在线发表了题为“An organoid library unveils subtype-specific IGF-1 dependency via a YAP–AP1 axis in human small cell lung cancer”的最新研究成果,该研究建立了一个包含40个患者来源的SCLC类器官库,这些类器官涵盖了所有已知的SCLC分子亚型。通过对这些类器官的全面分子和表型分析,研究人员发现非神经内分泌(非NE)型SCLC(包括YAP1和POU2F3亚型)依赖于胰岛素样生长因子(IGF-1)驱动的YAP1和AP1激活,而神经内分泌(NE)型SCLC(包括ASCL1和NEUROD1亚型)则不依赖于这些信号通路。研究进一步揭示了IGF-1受体(IGF1R)在非NE型SCLC中的关键作用,并通过体外和体内实验验证了IGF1R抑制剂对非NE型SCLC的治疗潜力。这些发现不仅为SCLC的精准治疗提供了新的靶点,也为未来基于亚型的治疗策略奠定了基础。

研究人员从手术切除的肿瘤、支气管镜活检样本、循环肿瘤细胞(CTCs)、痰液、胸腔积液、心包积液以及尸检样本中收集SCLC样本,并成功建立了40个SCLC类器官系。这些类器官在结构上表现出多种形态,包括球形、腺体状和梭形,并且在病理特征上与原始肿瘤高度一致,包括小圆细胞的多形性聚集、细胞质稀少和核深染等特征。
通过对SCLC类器官进行全外显子测序和转录组测序,研究人员发现这些类器官携带了与SCLC相关的典型基因突变,包括TP53和RB1的突变。此外,研究还检测到了一些罕见的融合基因,例如DENND2A-BRAF和UBE4B-PIK3CD,这些融合基因可能通过激活其激酶结构域促进肿瘤细胞增殖。通过RNA测序分析,研究人员确认了这些类器官涵盖了四种基于转录因子的SCLC亚型(ASCL1、NEUROD1、POU2F3和YAP1),并且这些亚型的特征在类器官培养过程中得以保留。
研究人员进一步探索了SCLC类器官对不同生长因子的依赖性。结果显示,NE型SCLC类器官可以独立于肺泡生态位因子生长,而非NE型SCLC类器官则依赖于IGF-1。这种依赖性可能与非NE型SCLC中IGF1R的高表达有关。通过流式细胞术和免疫印迹分析,研究人员发现非NE型SCLC类器官中IGF1R的蛋白表达水平显著高于NE型SCLC类器官,并且在IGF-1刺激下,非NE型SCLC类器官中IGF1R的磷酸化水平也显著增加。
为了深入理解IGF-1依赖性的分子机制,研究人员分析了IGF1R下游的信号通路。结果显示,IGF-1刺激可以显著增加非NE型SCLC类器官中AKT和ERK的磷酸化水平,而这种激活可以通过IGF1R抑制剂linsitinib得以抑制。进一步的研究发现,非NE型SCLC类器官中AP1家族成员FOSL1的表达水平显著高于NE型SCLC类器官,并且这种表达受到AKT的调控。此外,IGF-1刺激还可以诱导YAP1的核转位,并激活其下游靶基因CYR61的表达。这些结果表明,IGF-1通过IGF1R激活了AKT-AP1和FAK-YAP1信号通路,从而促进了非NE型SCLC的增殖。
基于上述发现,研究人员测试了IGF1R抑制剂对非NE型SCLC类器官的治疗效果。结果显示,非NE型SCLC类器官对IGF1R抑制剂linsitinib和NVP-ADW742表现出更高的敏感性。在体内实验中,linsitinib能够显著抑制YAP1亚型SCLC异种移植瘤的生长,并且与化疗药物顺铂联合使用时,治疗效果更为显著。这些结果表明,IGF1R抑制剂可能成为非NE型SCLC的潜在治疗手段。
为了进一步探索非NE型SCLC的起源和IGF-1依赖性的机制,研究人员利用CRISPR-Cas9技术在人类肺泡类器官中敲除了TP53和RB1基因。结果显示,TP53和RB1双敲除的肺泡类器官逐渐失去了对EGF的依赖,转而依赖于IGF-1。这些类器官表现出部分神经内分泌特征,并且YAP1的表达水平与非NE型SCLC类器官相似。这些结果表明,TP53和RB1的缺失可能促使肺泡上皮细胞向非NE型SCLC转变,并且这种转变伴随着对IGF-1的依赖性增加。
综上所述,该研究通过建立一个全面的SCLC类器官库,揭示了非NE型SCLC对IGF-1的依赖性及其分子机制。研究结果表明,IGF1R在非NE型SCLC中发挥着关键作用,并且IGF1R抑制剂可能成为针对这一亚型的有效治疗策略。此外,通过基因工程手段模拟SCLC的发生过程,研究人员进一步揭示了TP53和RB1缺失在非NE型SCLC发展中的作用。这些发现不仅为SCLC的精准治疗提供了新的靶点,也为未来基于亚型的治疗策略提供了理论依据。未来的研究可以进一步探索IGF1R抑制剂在临床中的应用,并深入研究非NE型SCLC的分子机制,以期开发出更有效的治疗方案。
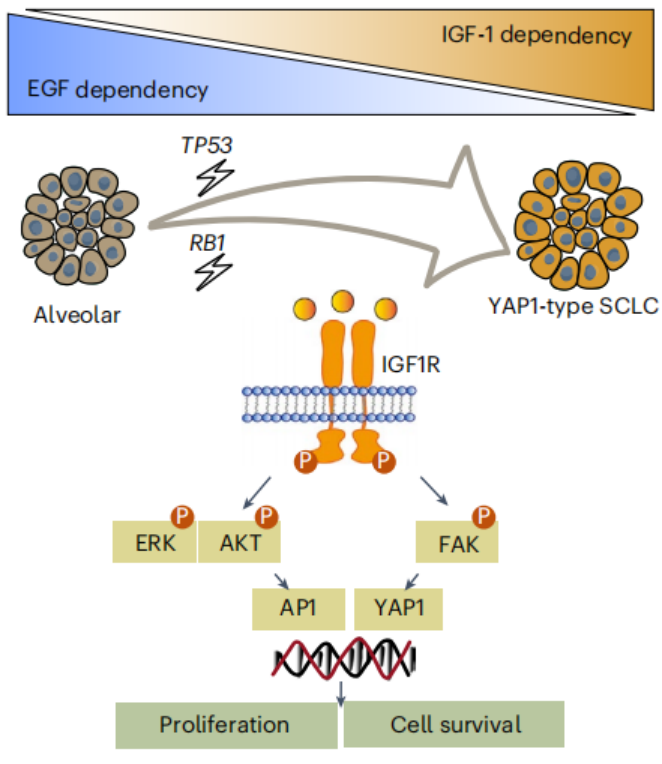
图 本研究模式图
原始出处:
An organoid library unveils subtype-specific IGF-1 dependency via a YAP-AP1 axis in human small cell lung cancer. Nat Cancer. 2025 Apr 30. doi: 10.1038/s43018-025-00945-y. Epub ahead of print. PMID: 40307487.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#小细胞肺癌# #胰岛素样生长因子1# #类器官库#
15