【论著选登】|鼻咽癌肝转移患者肝部分切除术与经导管动脉化疗栓塞术的远期疗效比较分析
2025-07-20 中国癌症杂志 中国癌症杂志 发表于上海
本研究旨在比较接受肝部分切除术和TACE治疗的NCLM患者的长期预后。CT)。为了避免NCLM的误诊,本研究中的肝转移诊断均
鼻咽癌(nasopharyngeal carcinoma,NPC)是中国南方常见的上皮源性恶性肿瘤,其中广东省发病率最高,每年每十万人中约有20人确诊[1]。NPC与头颈部其他鳞状细胞癌在生物学特性上存在差异,95%的病例为未分化癌,且远处转移发生率最高[2]。一旦合并转移,患者在姑息化疗后总体生存率很低。此外,与异时性肝转移患者相比,初次诊断时即合并肝转移的患者生存期明显缩短[3-4]。
肝脏是NPC常见的转移部位之一,肝转移通常为多发,预后比肺和骨转移差[5]。尽管肝部分切除术在治疗结直肠癌肝转移中的作用已得到证实,但许多发生肝转移的NPC患者由于病灶多发或合并肝外转移而无法行肝部分切除术[5]。最近多项回顾性研究[6-7]提示,对于肝转移灶数目较少的鼻咽癌肝转移(nasopharyngeal carcinoma liver metastasis,NCLM)患者,肝部分切除术比经导管动脉化疗栓塞术(transcatheter hepatic artery chemoembolization,TACE)具有生存优势。既往肝转移的诊断基于组织学评估、腹部超声和计算机体层成像(computed tomography,经病理学检查确诊。本研究旨在比较接受肝部分切除术和TACE治疗的NCLM患者的长期预后。CT)。为了避免NCLM的误诊,本研究中的肝转移诊断均
1 资料和方法
1.1 患者选择及分组
本研究严格遵循《赫尔辛基宣言》。本研究为回顾性研究,所有患者在入院时均签署了复旦大学附属肿瘤医院入院患者知情同意书,且已通过复旦大学附属肿瘤医院医学伦理委员会审查(伦理编号:2505-Exp189)。纳入2010年1月—2018年12月复旦大学附属肿瘤医院收治的诊断为NCLM的患者。纳入标准:① 年龄18周岁及以上,性别不限;② 肝穿刺活检确诊为NCLM;③ 美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分≤2分;④ 能够行肝脏病灶根治性切除;⑤ 肝脏储备功能良好(术前肝功能Child-Pugh A级,预计剩余肝脏体积≥30%);⑥ 血常规、凝血功能、肝肾功能、心电图、胸片等术前检查未见明确手术禁忌;⑦ 预计生存期≥6个月。排除标准: ① 年龄小于18周岁;② ECOG评分>2分;③ 合并肝外远处转移;④ 肝脏病灶无法R0切除;⑤ 肝脏储备功能不足(术前肝功能Child-Pugh B或C级且短期内无法降至A级,或预计剩余肝脏体积<30%);⑥ 术前检查见手术禁忌,如合并未能良好控制的心脏临床症状或疾病,凝血功能异常具有出血倾向或正在接受溶栓治疗等;⑦ 怀孕或哺乳期妇女;⑧ 有其他部位恶性肿瘤病史或严重的精神疾病等;⑨ 患者或家属无法理解本研究的条件和目标。其中,20例接受肝部分切除术的患者被纳入切除组,另外20例可切除的肝转移患者因患者拒绝接受手术而接受TACE治疗,这些患者作为TACE组。
1.2 治疗措施
尽管目前对NCLM进行肝部分切除术没有明确的手术指征,但越来越多的研究[8-9]提示手术切除可能使患者获益。本研究中,只有在不合并原发灶局部复发或肝外远处转移时才考虑进行肝部分切除术。首先通过骨骼发射计算机断层显像(emission computed tomography,ECT)、胸部CT或正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)排除肝外转移。根据Couinaud分类,大范围肝切除术定义为切除3个或更多肝段,小范围肝切除术定义为切除少于3个肝段[10-11]。R0切除定义为病理学切缘阴性的切除。采用吲哚菁绿15 min滞留时间来评估术前肝功能储备[12]。常规应用术中超声检查。肝切除手术适应证为:① 原发灶无复发;② 无肝外远处转移;③ 能够行肝脏病灶根治性切除;④ 肝脏储备功能良好(术前肝功能Child-Pugh A级,预计剩余肝脏体积≥30%);⑤ 术前检查未见明确手术禁忌。 TACE时将50 mg表柔比星、300 mg铂类药物和6 mg丝裂霉素与碘油以1∶1的比例混合制成乳剂。碘油的用量取决于肿瘤负荷和血管供应。肝切除术后患者如复查提示无肝内病灶,则不行常规系统治疗。术后肿瘤复发的治疗包括化疗、射频消融、经皮微波消融和经皮乙醇注射。住院死亡率定义为归因于肝切除术或TACE的死亡以及同一住院期间发生的所有死亡。
收集并分析患者纳入分组时的一般情况资料,包括性别、年龄、乙肝病毒感染情况、EB病毒感染情况、同时性或异时性肝转移、肝切除术前的合并症等,并综合考虑临床病理学资料和治疗结果,包括根治性或姑息性切除、手术方式、术后并发症及治疗后生存率等。
1.3 随访观察
主要研究结局是肿瘤相关死亡率。随访时间从肝切除术或TACE治疗当天计算到死亡日期或最后1次随访。患者纳入截至2018年12月31日。治疗后进行影像学检查(增强CT或磁共振)随访。进一步治疗基于临床评估、实验室检查和影像学评估结果。疾病稳定的患者每3个月进行1次影像学检查。随访包括体格检查、常规血液检查、肝功能检查、腹部超声检查或CT、胸部X光检查和头颈部磁共振。当有局部复发或远处转移的证据时进行骨扫描或PET/CT。
1.4 统计学处理
使用SPSS 21.0软件对本研究数据进行统计分析。分别使用Pearson χ2检验、Fisher精确概率法来计算切除组和TACE组患者分类和连续数值变量之间的统计学差异。采用Kaplan-Meier法分析患者的预后情况和估计生存率,并通过对数秩检验比较两组之间的差异。所有检验均为双侧,P <0.05为差异有统计学意义。
2 结 果
2.1 患者的临床病理学特征
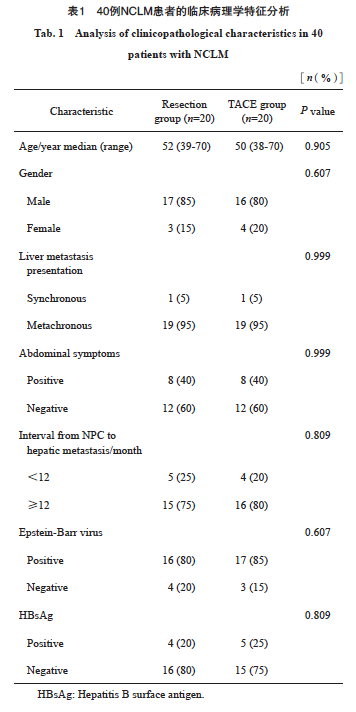
患者纳入和排除标准流程图见图1。最终纳入40例患者,其临床病理学特征见表1。两组患者入组时匹配了一般情况特点,在人口统计学、肿瘤特征、主要治疗、术前合并症和术后并发症方面均无显著差异。切除组和TACE组患者的中位年龄分别为52岁(39~70岁)和50岁(38~70岁)。切除组有17例男性和3例女性,而TACE组有16例男性和4例女性(P=0.607)。在实验室分析方面,切除组和TACE组患者的EB病毒感染率差异无统计学意义(P=0.607)。虽然发现9例患者有乙肝病毒感染,但没有患者患有严重肝硬化。所有标本的病理学类型均被证实为未分化非角化癌。切除组与TACE组各有1例患者为同时性肝转移,其余38例患者为异时性肝转移。
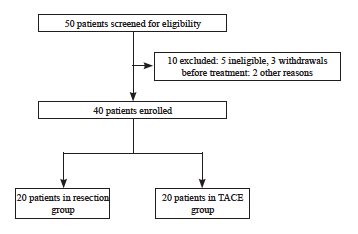
图1 患者纳入和排除标准流程图
Fig. 1 Flowchart of patient inclusion and exclusion criteria
2.2 患者的基线特征及治疗参数
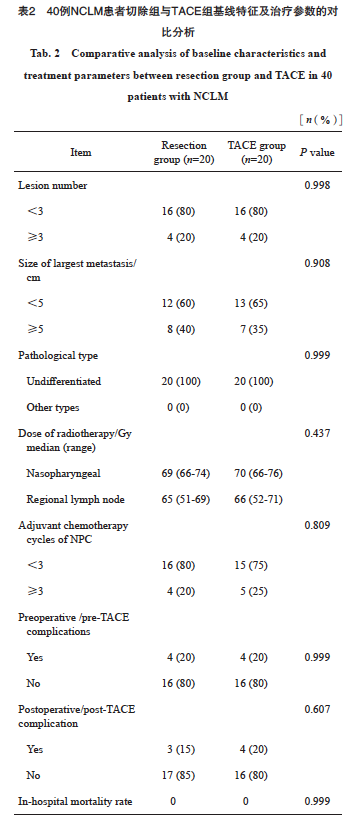
32例(80%)患者肝脏病灶少于3个,15例(37.5%)患者肝脏病灶最大直径>5 cm。骨扫描、PET/CT及胸部X光或CT影像学检查未见骨、肺或其他肝外远处转移征象。两组原发肿瘤的治疗均包括放疗和辅助化疗。NPC治疗的中位放射剂量:切除组为69 Gy(66~74 Gy),TACE组为70 Gy(66~76 Gy)。区域淋巴结治疗的中位放射剂量:切除组为65 Gy(51~69 Gy),TACE组为66 Gy(52~71 Gy)。两组间差异无统计学意义(P>0.05,表2)。主要化疗方案为5-氟尿嘧啶(5-FU)联合顺铂或以这两种药物为基础的其他方案。此外,两组间辅助化疗的反应也无显著差异(表2)。同时性肝转移患者对原发肿瘤进行了同步放化疗。所有患者在放疗和化疗后均实现区域淋巴结和原发灶完全缓解。
2.2 两组患者的生存获益和安全性分析
两组患者从原发肿瘤诊断到发现肝转移的间隔时间相似,切除组患者中位时间为17.1个月(2.4~48.6个月),而TACE组患者中位时间为15.3个月(3.0~31.2个月)。
20例行肝部分切除术患者术前均无明显肝炎或腹水。 5例患者行大范围肝切除,其余患者行小范围肝切除,包括节段切除和局部切除。标本解剖后,切除组患者发现23个转移灶,除4例边界不清外,大部分转移灶质地较硬,边界清晰。转移瘤无包膜。手术切缘中位宽度为2.2 cm(0.4~5.6 cm)。进一步分析发现19个转移瘤呈浸润性生长,血供不足,无包膜。3个肿瘤显示邻近器官侵犯并形成血栓。
TACE治疗组患者的TACE中位治疗次数为3次。本研究在TACE显像中也观察到转移灶存在血供不足的情况, TACE组18例患者肿瘤存在血供不足,仅2例患者肿瘤血供丰富。通常认为肿瘤血供不足可能会削弱TACE时化疗或栓塞的效果,因为化疗药物需要依靠血供才能进入肿瘤。
两组均无围手术期死亡病例。切除组患者和TACE组患者的术前合并症发生率差异无统计学意义(P=0.999)。切除组患者术后出现肝功能不全2例,出现胸腔积液1例,并发症发生原因与剩余肝体积无明显相关性。TACE组5例(25%)患者出现术后并发症。
随访期间切除组死亡5例(25%),TACE组死亡13例(65%)。肝部分切除术累计死亡率低于TACE[26.7% vs 66.7%,风险比(hazard ratio,HR)=6.25,95%CI:1.21~32.2,P=0.023]。切除组患者术后1、3和5年生存率分别为92%、67%和48%,中位生存期为44.3个月,TACE组患者治疗后1、3和5年生存率分别为93%、50%和10%(P=0.017),中位生存期为32.5个月(图2)。
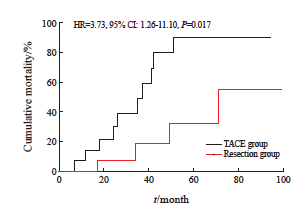
图2 肝切除组与TACE组的累积死亡率曲线
Fig. 2 Curve of cumulative mortality in hepatectomy group and TACE group
3 讨 论
本研究中,对于NCLM患者肝部分切除术比TACE具有生存优势,与肝部分切除术相比,TACE的累积死亡风险显著增加(3.73倍)。
NPC在东南亚及中国南方地区广泛流行,其中非角化未分化型约占95%,远处转移的倾向性最大,为17%~54%[13]。尽管近年来由于调强放疗技术和同期化疗的应用,NPC的局部控制效果良好,预后明显改善,2~5年总生存率超过90%,但远处转移仍是NPC治疗的一大挑战[14]。肝脏是NPC第3大常见转移部位,发生率为29.3%~36.0%[13,15],肝转移瘤通常表现为单个或多个实性肿块[16]。值得注意的是,肝转移是导致NPC患者预后较差的因素,肝转移确诊后的中位总生存期仅为3~5个 月[17]。联合化疗通常是一种姑息疗法,被认为是转移性NPC的标准治疗方案,尤其是对于多发性转移的患者。既往最常见的系统治疗是顺铂和5-FU,其反应率为66%~ 76%[18]。在过去的20年里,许多仅有肝转移的NPC患者接受了TACE局部治疗联合全身化疗的试验性治疗。尽管对NPC的化疗敏感性已经达成共识,但仅有少数报道涉及NPC原发灶完全缓解后进行肝转移灶手术治疗。
由于近年来影像学技术的进步、术前检查的准确性及肝切除技术的改进,肝转移灶的切除比以往取得了更多的治愈效果,并发症更少,死亡率更低[19-20]。目前认为肝部分切除术是结直肠癌和神经内分泌癌肝转移患者的有效且可能治愈的治疗方法,5年生存率为16%~76%[21-22]。与这些疾病相比,肝部分切除术在NCLM中也获得了较好的结果[9,23]。最近多项研究[6-7]表明,对于转移灶数目较少的NCLM患者,肝切除术比TACE具有生存优势。本研究为了避免肝转移的误诊,所有NPC患者的肝转移均经病理学检查确诊。为了获得满意的长期结果,本研究中两组肝转移患者都经过严格选择,避免对具有多个转移部位的侵袭性肿瘤进行额外治疗,此外合并肝外转移的患者不接受肝切除术。TACE组患者与切除组患者入组时的一般特点无显著差异。
由于转移灶的肝动脉供血和最佳剂量的靶向药物输送,TACE已被证明能有效控制局部肿瘤并改善生活质量。TACE对其他器官的损伤有限,较少引起术后并发症,因此也是晚期肝细胞癌的治疗选择[24]。本研究中,切除组患者比TACE组患者出现更多的并发症,如疼痛、发热和严重肝功能不全。但是切除组没有患者死于并发症或出院后留下的后遗症。两组患者对于疾病进展的干预治疗无显著差异。有研究[25]显示,转移性NPC患者的1年总生存率为20%~52%。既往研究[6]显示,肝切除组患者术后1、3和5年总生存率分别为85.7%、64.1%和40.2%, TACE组的1、3和5年长期生存率分别为53.3%、26.6%和20.0%,切除组患者术后长期生存率明显优于TACE组患者(P=0.039)。本研究中,切除组患者术后1、3和5年总生存率分别为92%、67%和48%,TACE组结果与既往报道值相近,1、3和5年生存率分别为93%、50%和10%,切除组患者术后长期生存率明显优于TACE组患者(P=0.017)及既往报道的患者[26-27]。需要说明的是,本研究纳入的病例数有限,无法对诸如肝脏病灶数目、大小等因素进行分层分析,未来需纳入更多病例以进一步证实。
目前对于结直肠癌肝转移的外科治疗研究[28]发现,肿瘤对于化疗的反应性是反映肿瘤生物学特性的重要因素,化疗反应好的患者行肝切除术后生存获益更多。本研究限于纳入患者的数量有限,无法做到分层分析探索肝切除术前新辅助治疗对预后的影响,后续研究拟扩大样本量,对此深入探索。
综上所述,与肝部分切除术相比,TACE显著增加了累积死亡风险。对于肝转移灶数目有限的NPC患者,肝切除术比TACE具有生存优势。由于NCLM患者的治疗选择有限,对于合适的患者,可以考虑推荐肝切除术。未来需要开展大样本前瞻性研究,以进一步验证这一结论。
第一作者:
王益林,博士,副主任医师。
通信作者:
王鲁,博士,主任医师,复旦大学附属肿瘤医院肝脏外科主任。
作者贡献声明:
王益林:提出研究方向,确定研究对象范围,收集数据,采集、清洗与分析数据,撰写论文;王鲁:修订论文,审核论文。
[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] WEI W I, SHAM J S. Nasopharyngeal carcinoma[J]. Lancet, 2005, 365(9476): 2041-2054.
[3] JIN Y, CAI X Y, CAI Y C, et al. To build a prognostic score model containing indispensible tumour markers for metastatic nasopharyngeal carcinoma in an epidemic area[J]. Eur J Cancer, 2012, 48(6): 882-888.
[4] LIU G Y, YE Y F, JIANG Y F, et al. Nab-paclitaxel, cisplatin, and capecitabine versus cisplatin and gemcitabine as first line chemotherapy in patients with recurrent or metastatic nasopharyngeal carcinoma: randomised phase 3 clinical trial[J]. BMJ, 2024, 385: e077890.
[5] LI W Z, HUA X, LV S H, et al. A scoring system based on nutritional and inflammatory parameters to predict the efficacy of first-line chemotherapy and survival outcomes for de novo metastatic nasopharyngeal carcinoma[J]. J Inflamm Res, 2021, 14: 817-828.
[6] HUANG J, LI Q J, ZHENG Y, et al. Partial hepatectomy for liver metastases from nasopharyngeal carcinoma: a comparative study and review of the literature[J]. BMC Cancer, 2014, 14: 818.
[7] FENG Y, ZHAO Y M, LI W W, et al. Hepatic rep prolongs overall survival in the selected patients with nasopharyngeal carcinoma liver metastases[J]. Eur J Surg Oncol, 2022, 48(10): 2202-2211.
[8] ELIAS D, CAVALCANTI DE ALBUQUERQUE A, EGGENSPIELER P, et al. Rep of liver metastases from a noncolorectal primary: indications and results based on 147 monocentric patients[J]. J Am Coll Surg, 1998, 187(5): 487-493.
[9] WEITZ J, BLUMGART L H, FONG Y, et al. Partial hepatectomy for metastases from noncolorectal, nonneuroendocrine carcinoma[J]. Ann Surg, 2005, 241(2): 269-276.
[10] POL B, CAMPAN P, HARDWIGSEN J, et al. Morbidity of major hepatic reps: a 100-case prospective study[J]. Eur J Surg, 1999, 165(5): 446-453.
[11] COUINAUD C. Anatomic principles of left and right regulated hepatectomy: technics[J]. J Chir (Paris), 1954, 70(12): 933-966.
[12] KAWASAKI S, SUGIYAMA Y, IGA T, et al. Pharmacokinetic study on the hepatic uptake of indocyanine green in cirrhotic patients[J]. Am J Gastroenterol, 1985, 80(10): 801-806.
[13] CHUA D T T, SHAM J S T, AU G K H. A phase II study of capecitabine in patients with recurrent and metastatic nasopharyngeal carcinoma pretreated with platinum-based chemotherapy[J]. Oral Oncol, 2003, 39(4): 361-366.
[14] LILLO S, MIRANDOLA A, VAI A, et al. Current status and future directions of proton therapy for head and neck carcinoma[J]. Cancers (Basel), 2024, 16(11): 2085.
[15] YU Y F, LU G Z, WANG R J, et al. Additional PD-1 inhibitor improves complete response to induction chemotherapy in locally advanced nasopharyngeal carcinoma[J]. Front Immunol, 2024, 15: 1415246.
[16] LIU Q X, WANG J F, SUN C P, et al. The diagnosis and management of rare cystic liver metastases from nasopharyngeal carcinoma: a case report[J]. Medicine (Baltimore), 2018, 97(26): e11257.
[17] JUAREZ-VIGNON WHALEY J J, AFKHAMI M, ONYSHCHENKO M, et al. Recurrent/metastatic nasopharyngeal carcinoma treatment from present to future: where are we and where are we heading?[J]. Curr Treat Options Oncol, 2023, 24(9): 1138-1166.
[18] DAI J X, ZHANG B, SU Y X, et al. Induction chemotherapy followed by radiotherapy vs chemoradiotherapy in nasopharyngeal carcinoma: a randomized clinical trial[J]. JAMA Oncol, 2024, 10(4): 456-463.
[19] DI CARLO S, CAVALLARO G, ROVERE F L, et al. Synchronous liver and peritoneal metastases from colorectal cancer: is cytoreductive surgery and hyperthermic intraperitoneal chemotherapy combined with liver rep a feasible option?[J]. Front Surg, 2022, 9: 1006591.
[20] POON R T, FAN S T, LO C M, et al. Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases: analysis of 1 222 consecutive patients from a prospective database[J]. Ann Surg, 2004, 240(4): 698-708;discussion 708-710.
[21] CHAMBERLAIN R S, CANES D, BROWN K T, et al. Hepatic neuroendocrine metastases: does intervention alter outcomes?[J]. J Am Coll Surg, 2000, 190(4): 432-445.
[22] FONG Y, COHEN A M, FORTNER J G, et al. Liver rep for colorectal metastases[J]. J Clin Oncol, 1997, 15(3): 938-946.
[23] DELIS S, BILIATIS I, BOURLI A, et al. Surgical rep of a solitary liver metastasis from nasopharyngeal carcinoma: a case report[J]. Hepatobiliary Pancreat Dis Int, 2006, 5(4): 610-612.
[24] CHEN L, WU L X, ZHANG L J, et al. Effect of metformin on hepatocellular carcinoma patients with type Ⅱ diabetes receiving transarterial chemoembolization: a multicenter retrospective cohort study[J]. Int J Surg, 2025, 111(1): 828-838.
[25] TAN E H, KHOO K S, WEE J, et al. Phase Ⅱ trial of a paclitaxel and carboplatin combination in Asian patients with metastatic nasopharyngeal carcinoma[J]. Ann Oncol, 1999, 10(2): 235-237.
[26] FOO K F, TAN E H, LEONG S S, et al. Gemcitabine in metastatic nasopharyngeal carcinoma of the undifferentiated type[J]. Ann Oncol, 2002, 13(1): 150-156.
[27] FANDI A, BACHOUCHI M, AZLI N, et al. Long-term diseasefree survivors in metastatic undifferentiated carcinoma of nasopharyngeal type[J]. J Clin Oncol, 2000, 18(6): 1324-1330.
[28] TREHUB Y, MALOVANNA A, ZEMSKOV S. The current state of perioperative chemotherapy in resectable colorectal liver metastases: a narrative review[J]. J Surg Oncol, 2025.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#鼻咽癌# #经导管动脉化疗栓塞术#
5 举报