重庆大学罗阳/暨南大学陈填烽团队Biomaterials:硒纳米颗粒抑制STAT1心肌细胞氧化应激和炎症减轻心脏缺血/再灌注损伤
2025-02-05 BioMed科技 BioMed科技 发表于陕西省
该工作揭示了硒纳米颗粒通过抑制氧化应激和巨噬细胞炎症反应减轻心肌缺血再灌注损伤,并提出STAT1是调控线粒体氧化应激和巨噬细胞炎症反应的潜在关键靶点。
缺血性心脏病是导致全世界人类死亡的第一因素,其中急性心肌梗死(AMI)是关键致死原因。随着医学的进步和医疗条件的改善,越来越多的AMI 病人有条件接受 PCI、溶栓和冠脉搭桥等血运重建治疗,对挽救患者生命,改善预后发挥了巨大作用,但困扰临床治疗的两大难题仍然没有解决:一是心梗后黄金救治期短,仅少数病人可以在心梗后2小时内完成血运重建。二是缺血-再灌注损伤,血供恢复的同时不可避免地持续引起心肌细胞死亡和广泛的炎症反应,导致进一步的心肌损伤,即再灌注损伤。由于心肌梗死及再灌注后的调控机制较为复杂,到目前为止,尚未开发出有效干预药物1。因此,进一步阐明心肌I/R调控机制,并寻找再灌注损伤的关键调控因子进行药物开发,具有重要意义。
2025年1月24日,重庆大学罗阳教授团队及暨南大学陈填烽教授团队在《Biomaterials》杂志在线发表了题为“Mitigation of ischemia/reperfusion injury via Selenium nanoparticles: suppression of STAT1 to inhibit cardiomyocyte oxidative stress and inflammation”的工作(通讯作者为罗阳教授/王志增副教授/陈填烽教授及吴伟研究员,第一作者为河南大学副教授陈春霞及其硕士研究生马晶晶、段书杰。)。该工作揭示了硒纳米颗粒通过抑制氧化应激和巨噬细胞炎症反应减轻心肌缺血再灌注损伤,并提出STAT1是调控线粒体氧化应激和巨噬细胞炎症反应的潜在关键靶点。

心脏缺血/再灌注损伤(I/RI)的特征是活性氧(ROS)和氮物质的大量产生、炎症和血流受损。过量的ROS产生可导致基因组不稳定、DNA损伤和炎症反应,进而导致线粒体功能障碍和心血管疾病2。然而,心肌梗死及再灌注后损伤的调节机制非常复杂,通过单一调节氧化应激、Ca2+超载、线粒体mPTP、pH异常、凋亡和坏死等的临床研究大多失败3,4。因此,需要寻找再灌注损伤的关键调控因子并开发多功能协同的新药物。
纳米技术为I/RI治疗策略的发展提供了巨大的前景。Lan等人报道了针对心肌细胞的抗炎纳米疗法5,Wang等人证实了负载 L-精氨酸的金纳米笼通过促进一氧化氮的产生和维持线粒体功能来改善心肌 I/RI6。然而这些纳米材料的结构具有复杂性和潜在毒性,而硒纳米颗粒 (SeNPs) 以其抗氧化和抗炎作用而闻名,具有低毒性和高特异性,使它们具有更广阔的应用前景。但是,关于SeNP 在 I/RI 中保护机制的影响尚未明确,因此研究人员对其进行了深入探索。
在本研究中,研究人员采用抗坏血酸(C6H8O6)还原亚硒酸(H2SeO3)的方法合成了均匀、稳定的球形SeNPs,可阻断 STAT1-ROS 的恶性循环,有效缓解氧化应激和炎症反应,并最终抑制 caspase激活诱导的心肌细胞凋亡。作者首先通过一系列的表征方法如DLS、SEM、AFM和XPS等证明了SeNPs的成功合成,接着采用NRVM和H9C2 心肌细胞系探索SeNPs 的抗氧化能力,结果表明SeNPs能抵抗 H2O2诱导的总抗氧化能力的降低并提高 GPx和GSH 的活性(图 1)。进一步探索研究者发现 SeNPs 在心肌细胞中主要通过内吞进入线粒体发挥抗氧化作用,通过TEM表明SeNPs 可能通过保留线粒体超微结构对心肌细胞发挥保护作用(图2)。
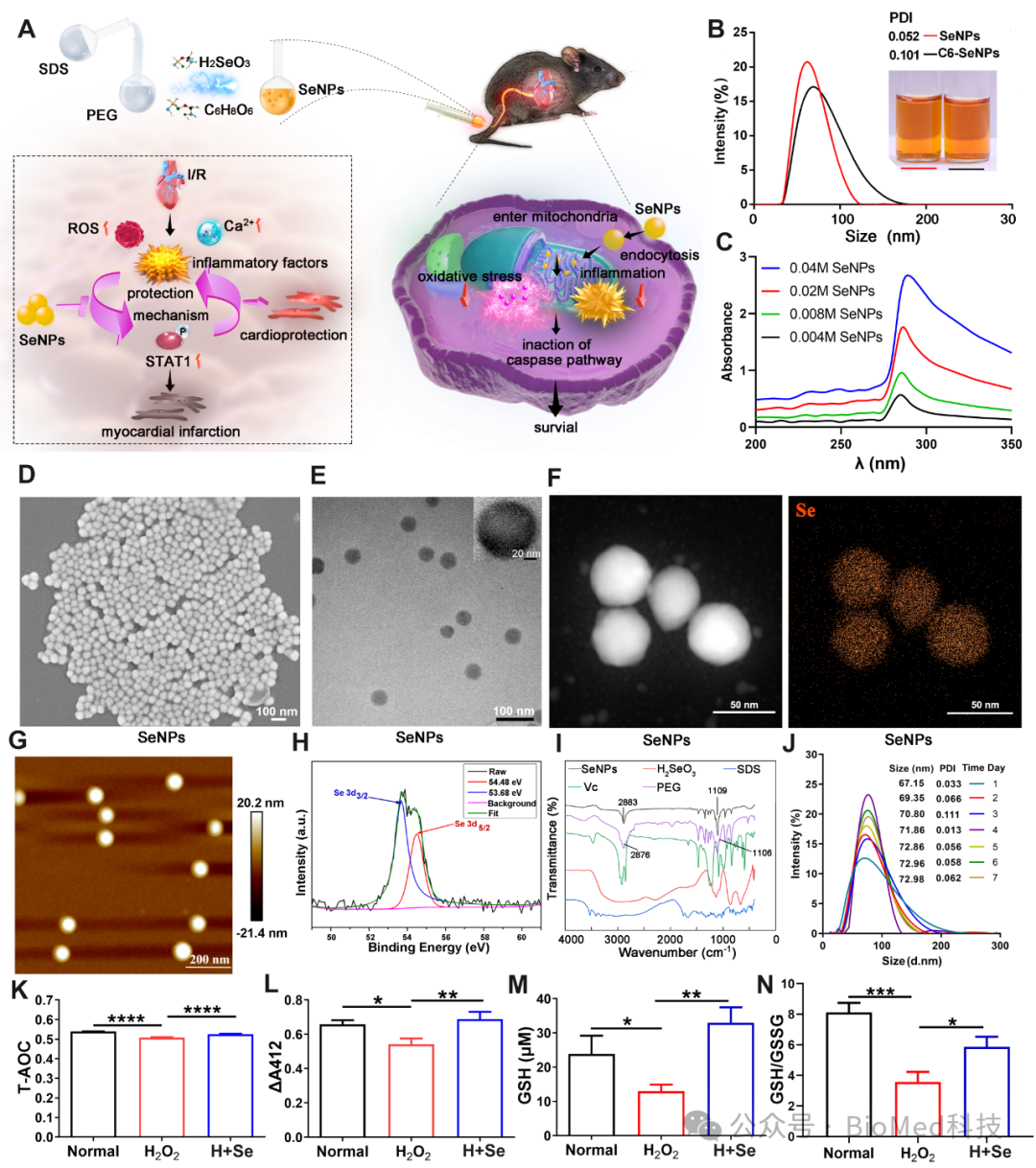
图1 SeNPs的合成、表征及抗氧化能力的检测
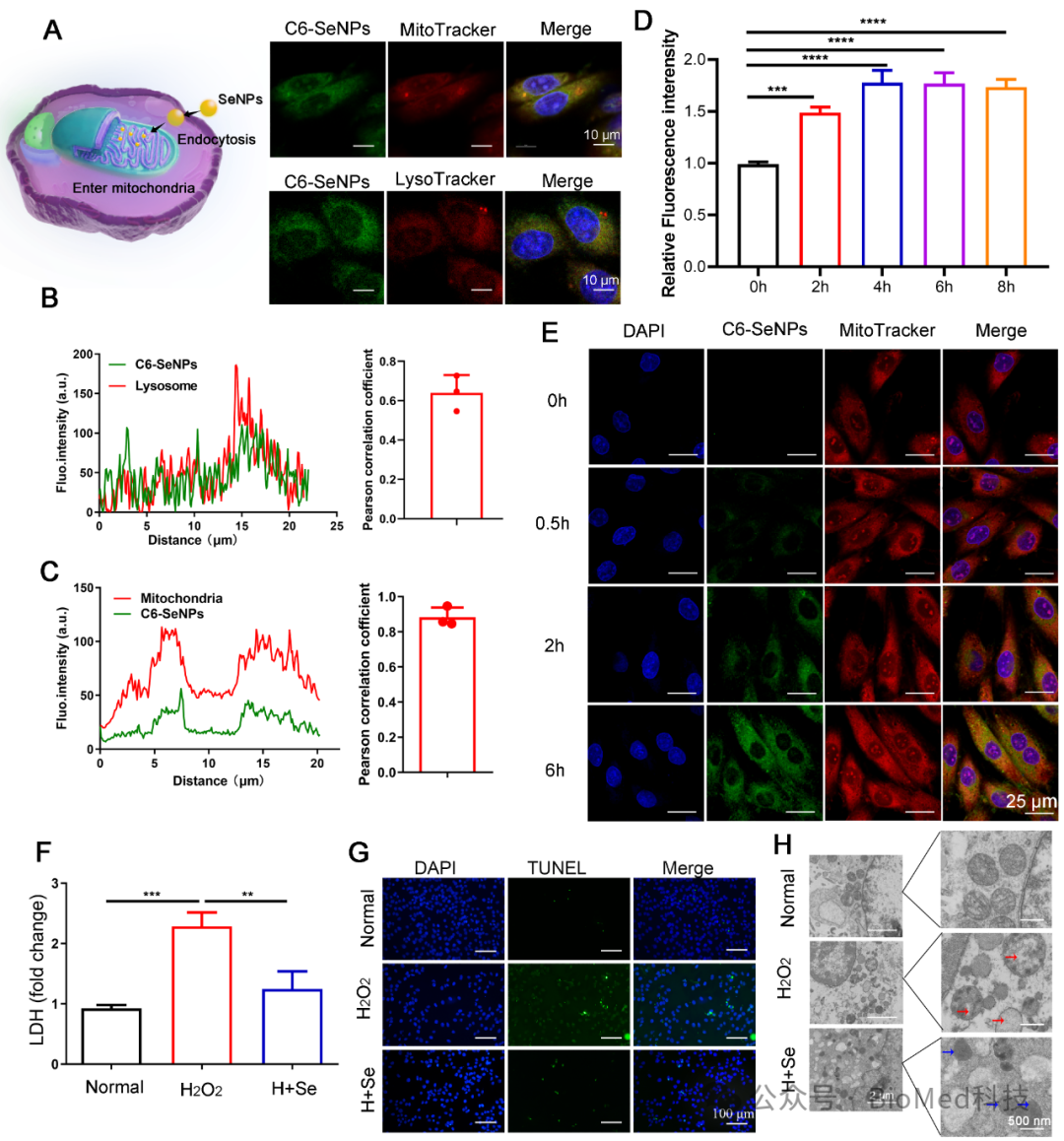
图2. SeNPs的摄取、定位及对氧化损伤的保护作用
为了进一步明确SeNPs对心肌细胞保护的具体机制,研究者发现SeNPs可缓解细胞氧化应激状态下ROS水平、线粒体膜电位(MMP)、Ca2+水平以及线粒体呼吸能力相关的的影响,其中通过对心肌细胞中 8-OHDG 表达水平的检测,表明 SeNPs对 mtDNA 有显著的保护作用。因此,保护 mtDNA 和最大限度地减少线粒体功能障碍是缓解心肌 I/RI 的可行治疗选择(图3),表明SeNPs一种潜在的药物可以保护DNA 和维持线粒体的功能。
此外,研究者通过体内小鼠I/RI模型中SeNPs与心肌细胞中线粒体的良好共定位,以及SeNPs可有效地提高缺血再灌注后血清中相关过氧化氢酶的水平,降低凋亡基因的表达(图4),表明SeNPs主要进入小鼠心脏发挥作用,从而缓解I/RI所带来的损伤。同时,研究者通过单梗模型进一步模拟SeNPs对临床心肌梗死患者再灌注前的保护作用,结果显示SeNPs 可以有效保护心肌细胞功能,避免纤维化减少和心室壁弱化(图5),这表明SeNPs可有效缓解心力衰竭。
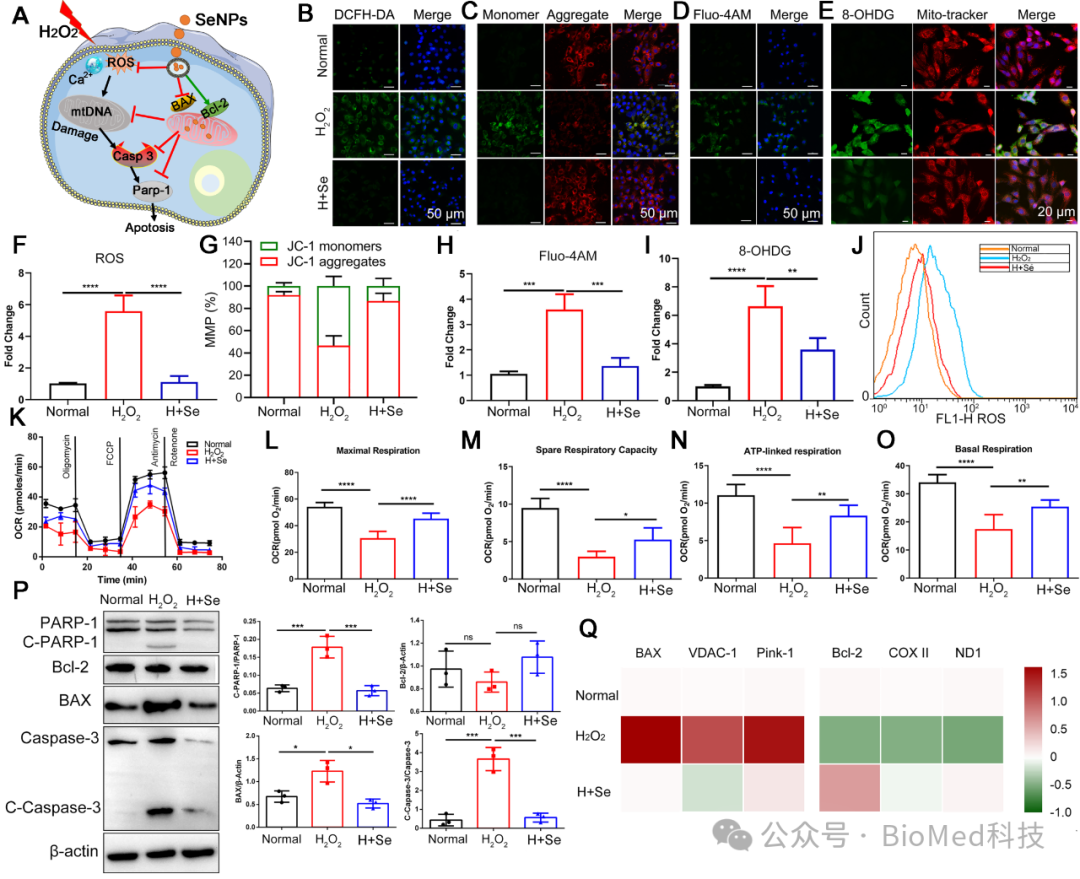
图3. SeNPs对心肌细胞的保护作用
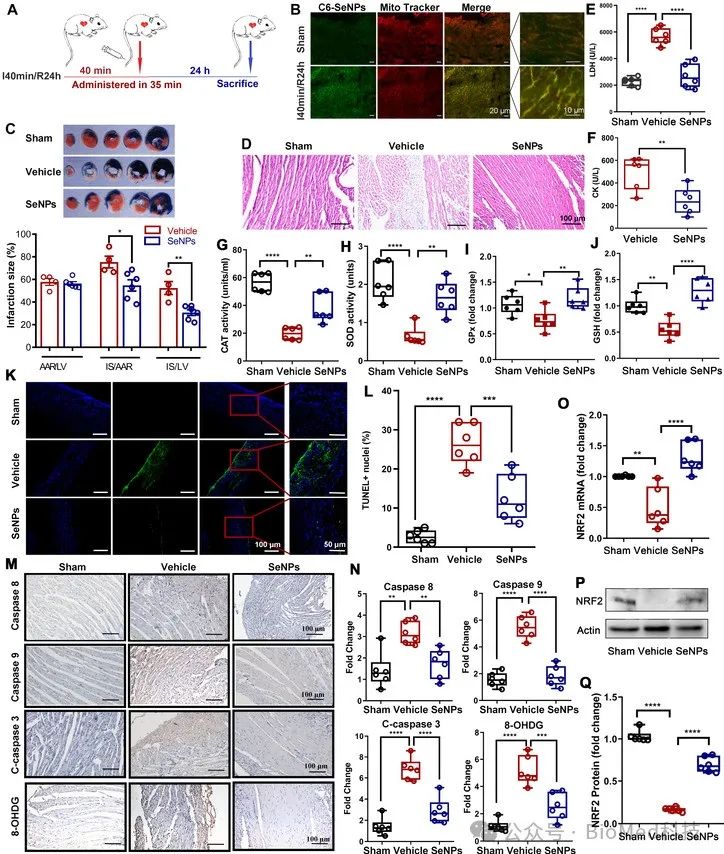
图4. SeNPs显著减轻了小鼠心肌缺血再灌注损伤
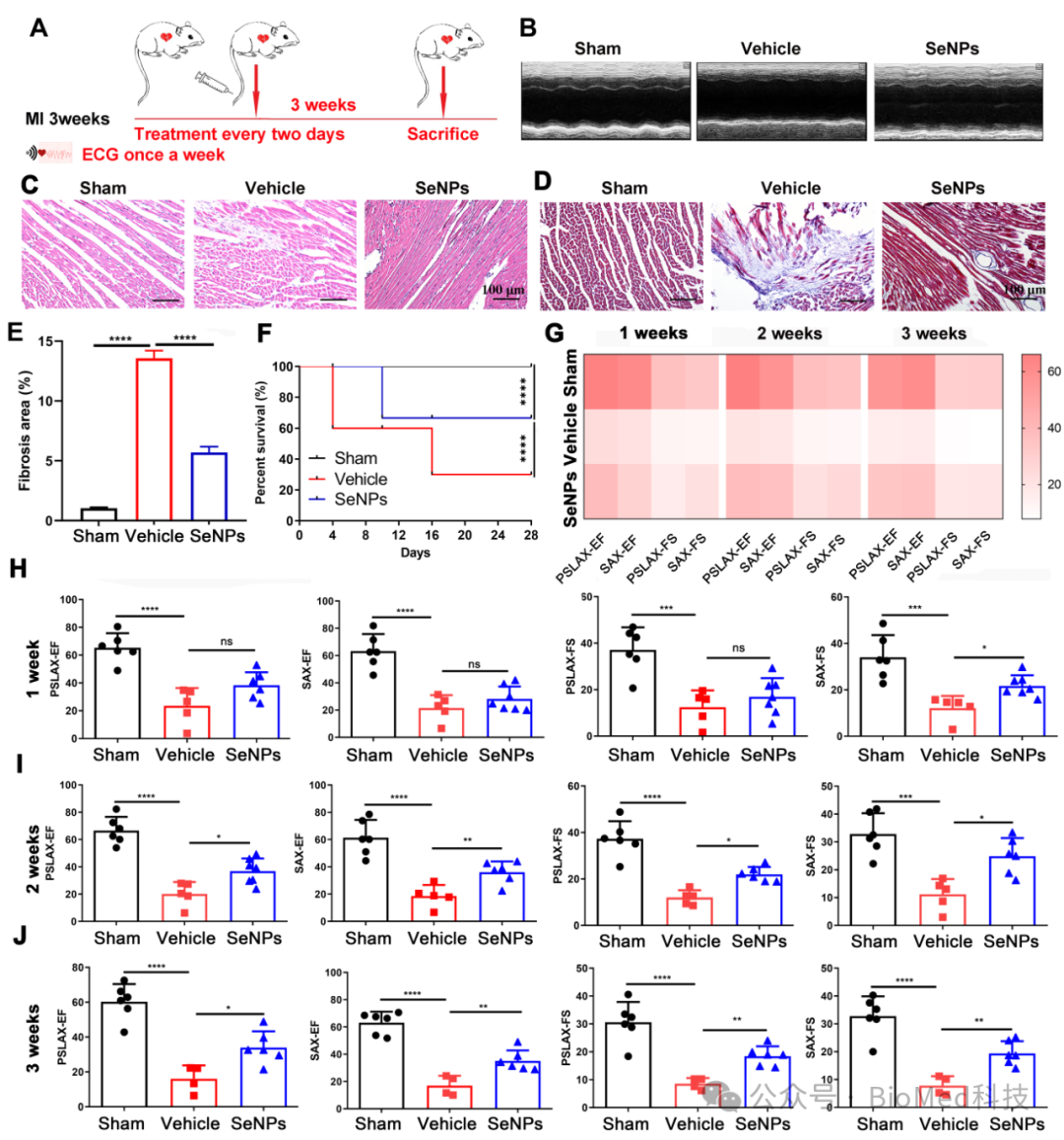
图5. SeNPs可减轻单梗模型小鼠心肌梗死,并抑制炎症因子的表达。
炎症反应贯穿缺血及再灌注整个过程,巨噬细胞作为炎症反应的关键调节因子,在缺血及再灌注后心肌损伤与修复过程中均发挥重要作用。进一步研究者发现SeNPs能显著抑制细胞和组织中炎症因子的表达以及小鼠血清中炎症因子的分泌,这与SeNPs抑制巨噬细胞极化为M1型相关,从而进一步保护心肌细胞不受损伤(图6)。单细胞转录组测序进一步验证了SeNPs 处理组显着影响心肌细胞和单核巨噬细胞的数量以及抑制巨噬细胞浸润,GO富集分析显示STAT1基因的表达存在显著差异,且与线粒体和氧化应激的关系更密切(图7)。研究者进一步挖掘STAT1基因在氧化损伤保护分子的作用,荧光共定位发现STAT1 可以定位于线粒体,通过与 ROS 和炎症相互作用加重细胞损伤。通过抑制STAT1 线粒体转位和核易位,可有效地保护心肌细胞免受 I/RI 感染的有效策略(图8),这表明STAT1基因在调控心肌梗死发病机制中的重要作用。
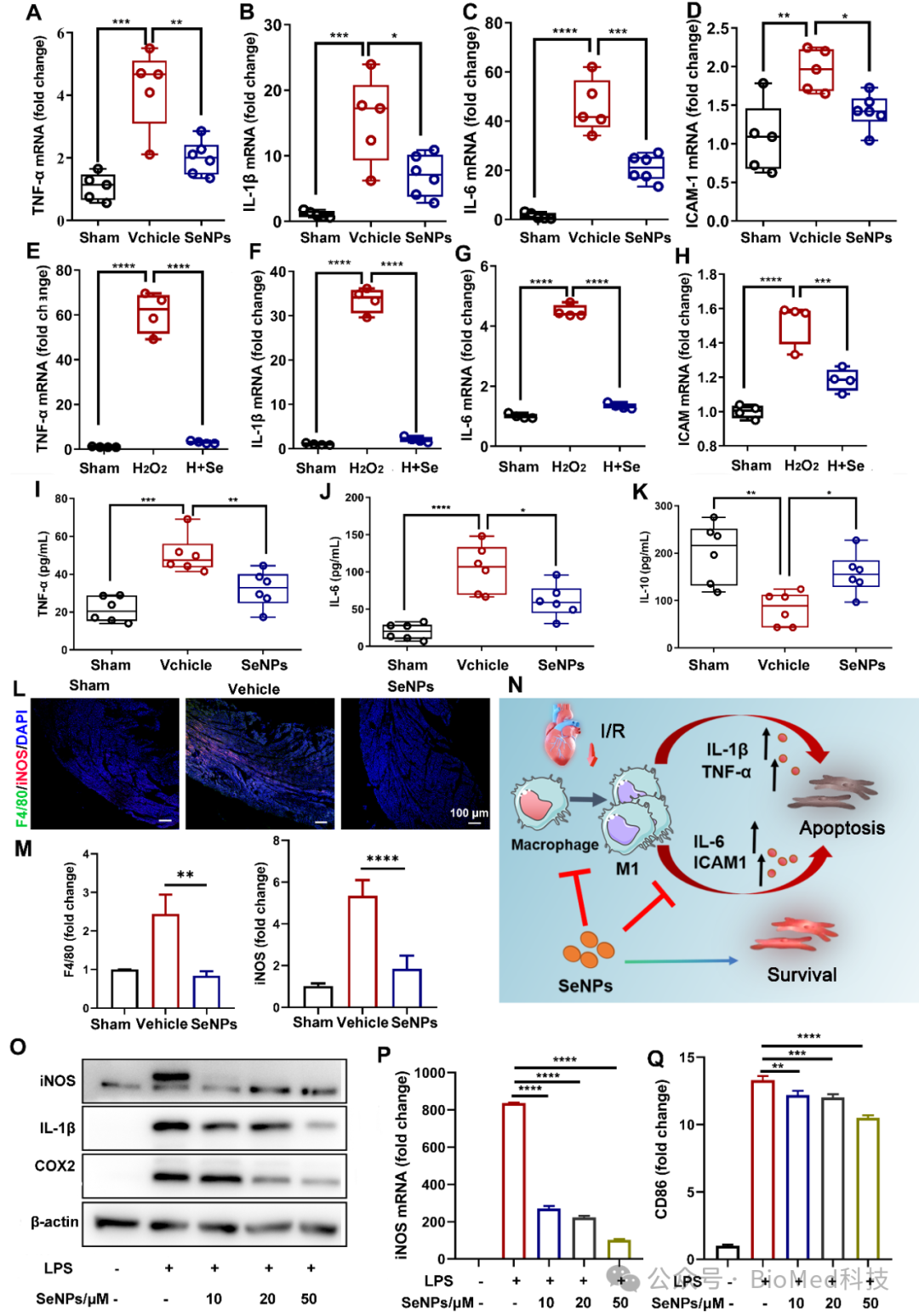
图6. SeNPs调节巨噬细胞极化及炎症因子的表达
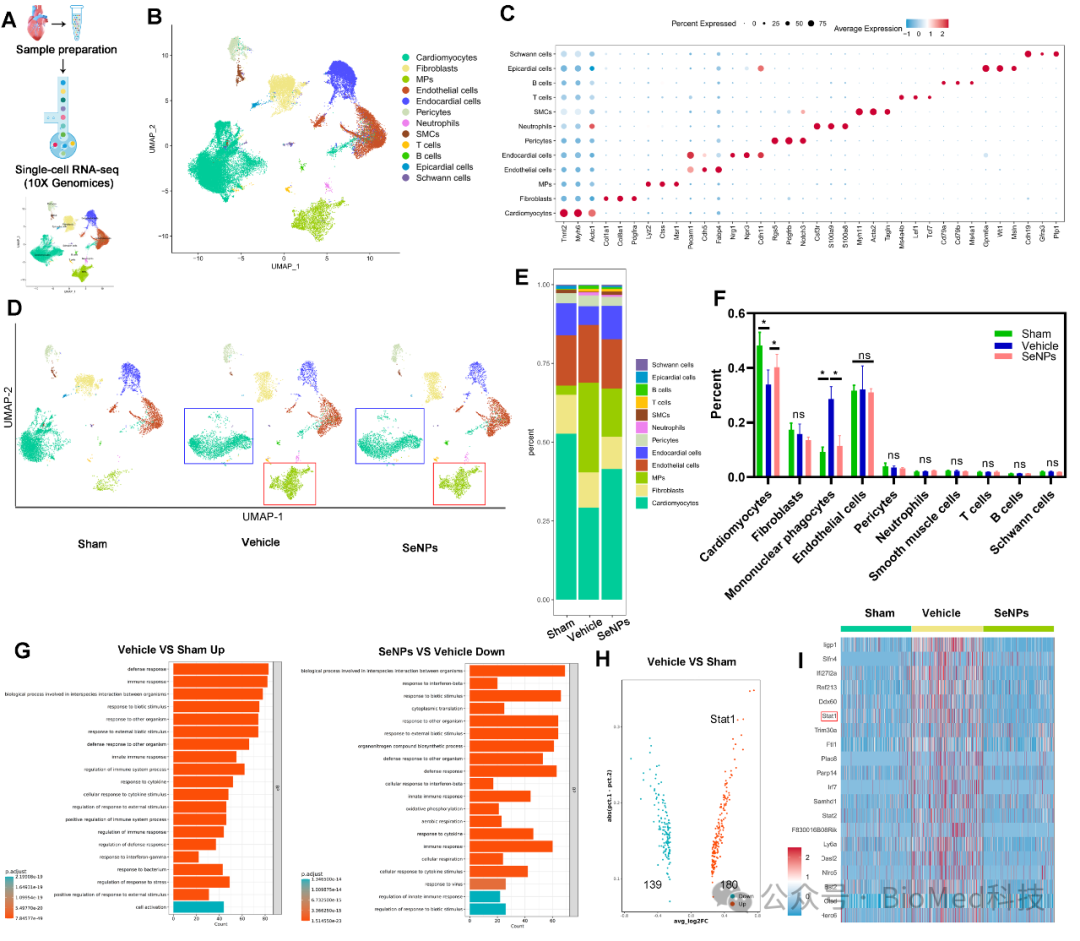
图7. 单细胞测序结果分析
综上所述,研究人员成功合成了具有优异抗氧化和抗炎作用的球形 SeNPs。一方面,该SeNPs 主要通过内吞作用定位于心肌细胞线粒体内以保护心肌细胞免受损伤;另一方面,该SeNPs 通过清除 ROS、减少 Ca2+过载、减轻 mtDNA 损伤和恢复线粒体功能从而有效缓解氧化应激。此外,SeNPs 通过抑制巨噬细胞浸润、抑制 M1 极化和减少炎症介质释放表现出有效的抗炎特性。研究人员还发现 STAT1 在细胞中的关键作用,SeNPs 通过抑制线粒体 STAT1 内流,从而发挥对心脏的保护作用。总的来说,本研究证明了一种治疗 MI 的有效候选药物:MI 后及时注射 SeNPs可显著缓解心肌细胞死亡的发生,且心脏纤维化,并起到双重保护作用,不仅可以延长 MI 患者的黄金治疗时间,而且可以显著减轻再灌注损伤。
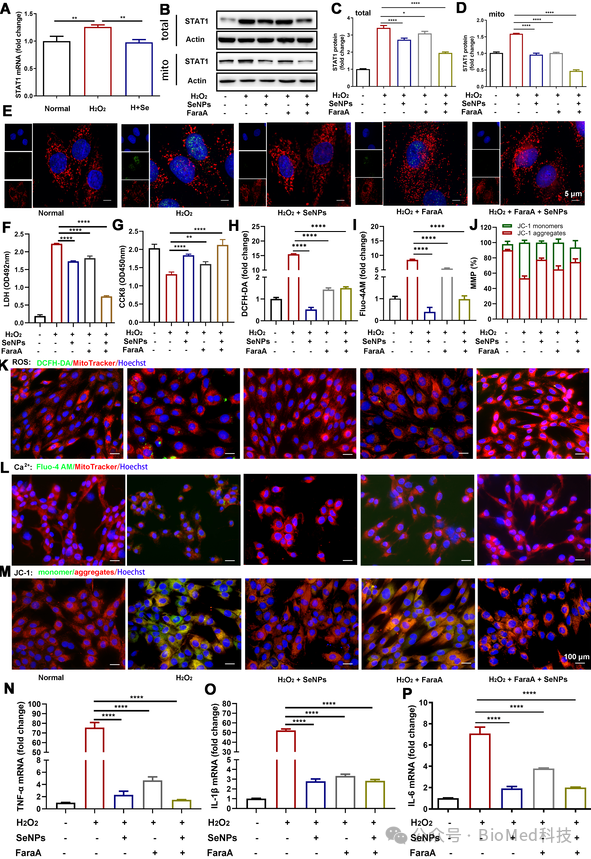
图8. SeNPs抑制STAT1的线粒体易位,阻断STAT1-ROS恶性循环
参考文献
1. D.M. Yellon, D.J. Hausenloy, Myocardial reperfusion injury, N. Engl. J. Med. 357
(2007) 1121–1135, https://doi.org/10.1172/JCI62874.
2. S. Cadenas, J. Aragonés, M.O. Landázuri, Mitochondrial reprogramming through cardiac oxygen sensors in ischaemic heart disease, Cardiovasc. Res. 88 (2010) 219–228, https://doi.org/10.1093/cvr/cvq256.
3. R.A. Kloner, Current state of clinical translation of cardioprotective agents for acute myocardial infarction, Circ. Res. 113 (2013) 451–463, https://doi.org/10.1161/CIRCRESAHA.112.300627.
4. P. Joseph, S. Yusuf, Coordinating efforts to reduce the global incidence of cardiovascular disease, N. Engl. J. Med. 389 (2023) 1329–1331, https://doi.org/ 10.1056/NEJMe2309401.
5. M. Lan, M. Hou, J. Yan, Q. Deng, Z. Zhao, S. Lv, J. Dang, M. Yin, Y. Ji, L. Yin, Cardiomyocyte-targeted anti-inflammatory nanotherapeutics against myocardial ischemia reperfusion (IR) injury, Nano Res. 15 (2022) 9125–9134, https://doi.org/ 10.1007/s12274-022-4553-6.
6. Z. Wang, N. Yang, Y. Hou, Y. Li, C. Yin, E. Yang, H. Cao, G. Hu, J. Xue, J. Yang, Z. Liao, W. Wang, D. Sun, C. Fan, L. Zheng, L-Arginine-Loaded gold nanocages ameliorate myocardial ischemia/reperfusion injury by promoting nitric oxide production and maintaining mitochondrial function, Adv. Sci. 10 (2023)e2302123, https://doi.org/10.1002/advs.202302123.
原文链接:
www.sciencedirect.com/science/article/pii/S0142961225000389
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#STAT1# #心脏缺血/再灌注损伤#
18